
MULPLETA是一种血小板生成素受体激动剂,用于治疗成人慢性肝病患者的血小板减少症,这些患者计划接受手术
1、在预定程序前8-14天开始MULPLETA给药。
2、患者应在最后一次给药后2-8天接受手术。
3、推荐剂量:每日口服3毫克,持续7天。
血栓形成/血栓栓塞并发症:MULPLETA是一种血小板生成素(TPO)受体激动剂,TPO受体激动剂与慢性肝病患者的血栓形成和血栓栓塞并发症有关。
监测血小板计数和血栓栓塞事件并立即进行治疗
最常见的不良反应(≥3%):头痛。
30℃以下保存。
24个月
片剂
日本盐野义
芦曲泊帕商品名:Mulpleta,是一款口服的人类血小板生成素受体激动剂(TPO-R),能与巨核细胞表面的TPO受体相结合,诱导这些细胞的增殖、分化与成熟,从而上调血小板的产生。该药于2015年9月获日本厚生劳动省的批准,在选择进行侵入性手术的慢性肝脏疾病患者中,改善他们的血小板减少症病情;于2018年7月获FDA批准,用于治疗患有血小板减少症的特定成人患者群体,这些患者同时患有慢性肝脏疾病,并有接受手术的计划。
米伐木肽治疗应由在骨肉瘤诊断和治疗方面有经验的专科医生启动和监督。
1、剂量学
所有患者的mifamurtide(米伐木肽)推荐剂量为 2 mg/m2 体表面积。切除后应作为辅助治疗给药:每周2次,至少间隔3天,持续12周,随后每周1次治疗,再持续24周,36周内共输注48次。
2、特殊人群
>30岁的成人在骨肉瘤研究中接受治疗的患者均为65岁或以上,在 III 期随机化研究中,仅纳入了年龄≤30岁的患者。因此,没有足够的数据推荐 MEPACT 在 > 30岁的患者中使用。
3、肾损害或肝损害
轻度至中度肾损害(肌酐清除率 (CrCL)≥30 mL/min)或肝损害(Child-Pugh A级或 B 级)对mifamurtide(米伐木肽) 的药代动力学无具有临床意义的影响;因此,无需对这些患者进行剂量调整。但是,由于中度肝损害受试者中mifamurtide(米伐木肽) 的药代动力学变异性较大,且中度肝损害患者的安全性数据有限,因此建议中度肝损害患者慎用mifamurtide(米伐木肽)。
由于尚无 mifamurtide 在重度肾损害或肝损害患者中的药代动力学数据,因此建议这些患者慎用mifamurtide(米伐木肽)。如果在化疗完成后使用mifamurtide(米伐木肽),建议继续监测肾脏和肝脏功能,直至所有治疗完成。
4、<2岁儿童人群
尚未确定mifamurtide(米伐木肽)在0-2岁儿童中的安全性和疗效。无可用数据。
给药方法
MEPACT(米伐木肽)通过静脉输注给药,持续1小时。
MEPACT(米伐木肽)不得推注给药。
关于给药前复溶、使用提供的过滤器过滤和稀释药品的进一步说明。
最常见的不良反应(≥3%):头痛。
血栓形成/血栓栓塞并发症:MULPLETA是一种血小板生成素(TPO)受体激动剂,TPO受体激动剂与慢性肝病患者的血栓形成和血栓栓塞并发症有关。
监测血小板计数和血栓栓塞事件并立即进行治疗。


芦曲泊帕
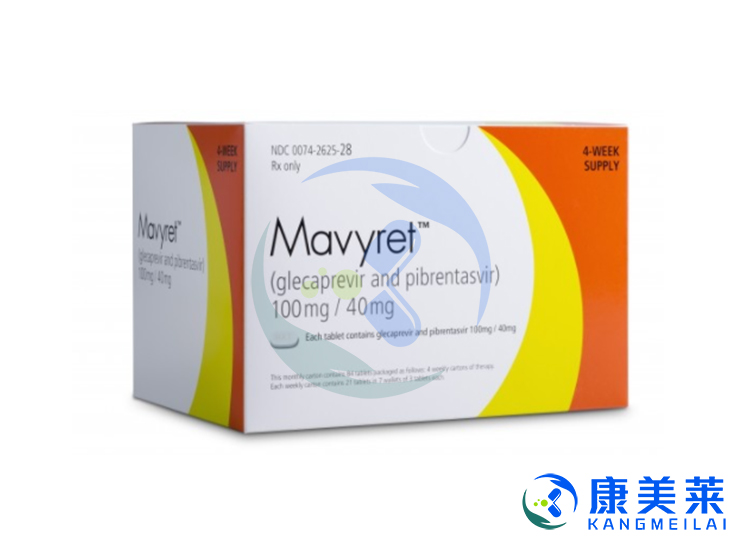
格卡瑞韦/哌仑他韦(glecaprevir/pibrentasvir)
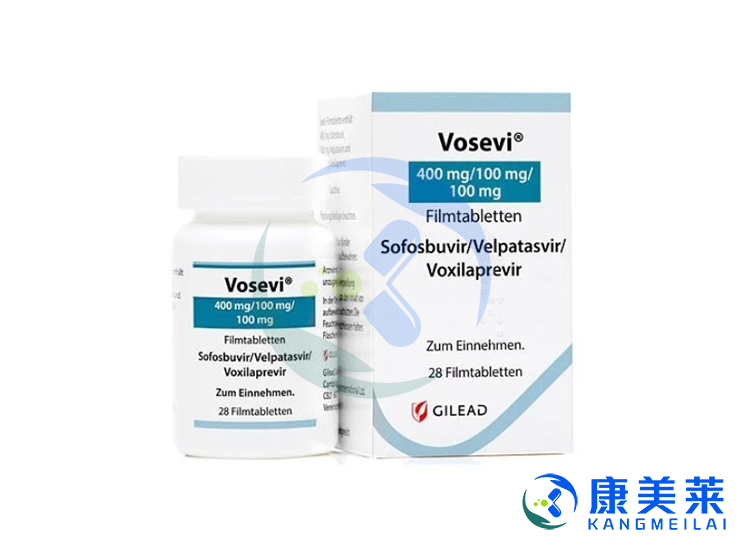
吉四代(Vosevi)
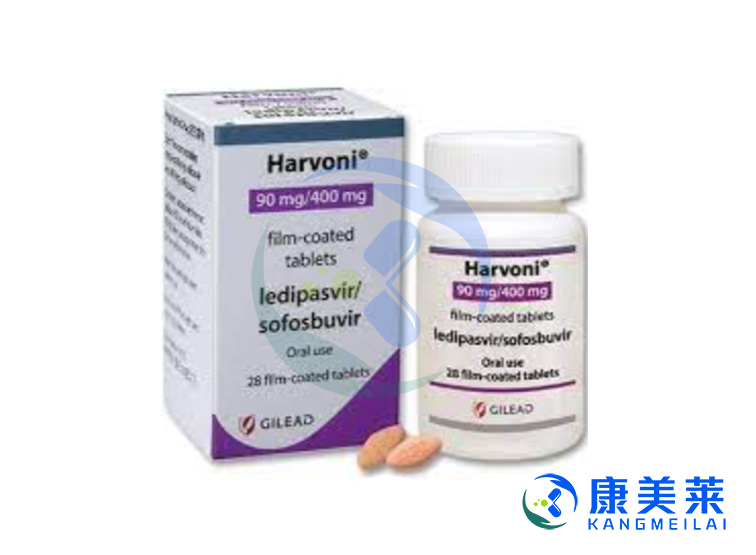
吉二代(雷迪帕韦索非布韦)

达拉他韦(达卡他韦)