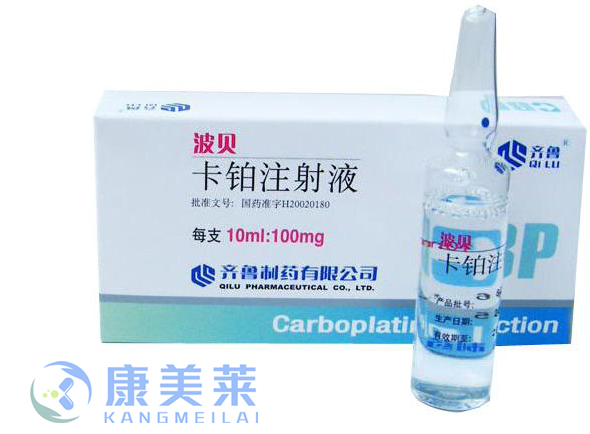
通用名:卡铂
商品名:波贝
全部名称:卡铂,碳铂,卡波铂,铂尔定,顺二氨环丁铂,顺二氨环丁羧酸铂,波贝,Carboplatin,Paraplatin,Carboplat,Ercar
主要适用于卵巢癌、肺癌、头颈部癌、生殖细胞肿瘤、甲状腺癌、宫颈癌、膀胱癌等。
静脉滴注或静脉注射:一次给药法,每次300~400mg/m2,28日重复,儿童可提高到560mg/m2;连续给药5日,100mg/次,或每次50~70mg/m2。用生理盐水或5%葡萄糖注射液稀释。
胸腹腔内注射:其剂量高于静脉内给药。
(1)骨髓抑制:为剂量限制性毒性,长期大剂量给药时,可使血小板、血红蛋白、白细胞减少,一般发生在用药后的14~21日,停药后3~4周恢复。
(2)胃肠道反应:食欲减退、恶心、呕吐,较DDP(顺铂)轻微。
(3)在常规剂量下,对肝、肾、心脏功能无明显影响。
(4)神经毒性、耳毒性、脱发及头晕等不良反应低于DDP,偶见变态反应。神经毒性是指或趾麻木或麻刺感,有蓄积作用;耳毒性首先发生高频率的听觉丧失,耳鸣偶见。
(5)过敏反应(皮疹或瘙痒,偶见喘鸣),发生于使用后几分钟之内。
有明显骨髓抑制及肝肾功能不全者,孕妇及有严重并发症者,对本品或其他铂类制剂及甘露醇过敏者均禁用。
(1)使用本品前用生理盐水或5%葡萄糖注射剂10ml溶解,然后用5%葡萄糖注射液250-500ml稀释,静脉滴注半小时或1小时。使用CBP时,虽不必水化,但应鼓励患者多饮水,排尿量保持在每日2000ml左右。
(2)本品溶解后,应在8小时内用完,并避光。
(3)本品只作静脉给药,应避免漏于血管外。
(4)本品应避免与铝化物接触,也不宜与其他药物混合滴注。
(5)用药前及用药期内应定期检查血像、肝肾功能等。
(6)用药期间患者应随访检查听力、神经功能、血液尿素氮、肌酐清除率与血清肌酐测定、红细胞压积、血红蛋白测定、白细胞分类与血小板计数、血清钙、镁、钾、钠含量的测定。
室温避光保存。
卡铂是第二代铂类复合物,由于其抗肿瘤活性较强,消化道反应及肾毒性较低,因而得到广泛应用。它能与DNA结合,形成交叉键,破坏了DNA的功能,使其不能再复制合成,对生长各期的肿瘤细胞均有杀伤作用,是一种细胞周期非特异性药物。
对于三阴性乳腺癌的患者,新辅助化疗后增加卡铂可以提高病理缓解的的概率。一些新辅助化疗的研究已经表明三阴性乳腺癌的患者对铂类化合物以及卡铂是敏感的,尤其是有BRCA突变的那些患者。
GeparSixto研究评估了对595例患者将卡铂加入到到紫杉醇联合脂质体阿霉素周疗共18周治疗的效果。加用卡铂明显的增加了病理完全缓解的概率,对照组37.2%而卡铂组46.7%(P<0.2)。应用其它的更广泛的病理学缓解的定义,也观察到同样的结果,绝对的差异由8%到10%。然而,药物作用造成在三阴性乳腺癌亚组患者结果的不同,对照组病理完全缓解患者为37.9%而卡铂组为58.7%(P<0.05)。
完整说明书详见:https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/f88e0483-09be-4f60-be8f-964c02e3ece0/spl-doc?hl=Paraplatin
在入组三项多中心、开放性、单组临床试验之一的携带 NTRK 融合基因的不可切除或转移性实体瘤儿童和成人患者中评价了 VITRAKVI 的疗效:研究LOXO-TRK-14001(NCT02122913)、SCOUT(NCT02637687) 和NAVIGATE(NCT02576431)。要求所有患者在疾病全身治疗后进展(如可用),或需要手术治疗局部晚期疾病且发病率显著。
成人患者接受 VITRAKVI 100 mg 口服每日两次,儿童患者(18岁或以下)接受VITRAKVI 100 mg/m 2,最大剂量为 100 mg 口服每日两次,直至出现不可接受的毒性或疾病进展。在当地实验室使用下一代测序 (NGS) 或荧光原位杂交 (FISH) 前瞻性确定阳性 NTRK 基因融合状态。在3例经 FISH 证实携带 ETV6 易位的婴儿型纤维肉瘤患者中推断存在 NTRK 融合基因。主要疗效结局指标为总缓解率 (ORR) 和缓解持续时间 (DOR),由盲态独立审查委员会 (BIRC) 根据RECIST v1.1确定。
疗效评估基于入组的3项临床试验的携带 NTRK 融合基因的前55例实体瘤患者。基线特征为:中位年龄45岁(范围4个月至76岁);22% < 18岁,78%≥18岁;53%男性;67%白人;7%西班牙裔/拉丁裔,4%亚裔,4%黑人;ECOG体能状态为0-1(93%) 或2(7%)。82%的患者为转移性疾病,18%为局部晚期、不可切除疾病。98%的患者既往接受过癌症治疗,包括手术、放疗或全身治疗。其中,82%(n = 45) 既往接受过全身治疗,中位既往全身治疗方案为2种,35%(n = 19) 既往接受过3种或3种以上全身治疗方案。最常见的癌症为唾液腺肿瘤 (22%)、软组织肉瘤 (20%)、婴儿纤维肉瘤 (13%) 和甲状腺癌 (9%)。NGS和 FISH 分别检出50和5例 NTRK 和 NTRK 基因融合。
疗效结果总结见表4、5和6。
表4 携带 NTRK 融合基因的实体瘤患者的疗效结果
|
疗效参数 |
VITRAKVI N = 55 |
|
总缓解率 (95%CI) |
75% (61%, 85%) |
|
完全缓解率 |
22% |
|
部分缓解率* |
53% |
|
缓解持续时间** |
N = 41 |
|
范围(月) |
1.6 + , 33.2 + |
|
持续时间≥6个月的患者百分比 |
73% |
|
持续时间≥9个月的患者百分比*** |
63% |
|
持续时间≥12个月的患者百分比**** |
39% |
+ 表示持续缓解。
*包括1例患有不可切除的婴儿纤维肉瘤的儿童患者,该患者在部分缓解后接受了切除术,并且在数据截止时仍无疾病。
**在数据截止时未达到中位缓解持续时间。
***3例持续缓解的患者从开始缓解后随访 < 9个月。
****对10例持续缓解的患者随访至缓解开始后 < 12个月。
表5 不同肿瘤类型的疗效结果|
肿瘤类型 |
患者 (N = 55) |
客观缓解率 |
DOR |
|
|
|
|
% |
95% CI |
范围(月) |
|
软组织肉瘤 |
11 |
91% |
(59%, 100%) |
3.6, 33.2 + |
|
唾液腺 |
12 |
83% |
(52%, 98%) |
7.7, 27.9 + |
|
婴儿纤维肉瘤 |
7 |
100% |
(59%, 100%) |
1.4 + , 10.2 + |
|
甲状腺 |
5 |
100% |
(48%, 100%) |
3.7, 27.0 + |
|
肺 |
4 |
75% |
(19%, 99%) |
8.2, 20.3 + |
|
黑色素瘤 |
4 |
50% |
NA |
1.9、17.5 + * |
|
结肠 |
4 |
25% |
NA |
5.6 * |
|
胃肠道间质瘤 |
3 |
100% |
(29%, 100%) |
9.5, 17.3 |
|
胆管癌 |
2 |
SD、NE |
NA |
NA |
|
附录 |
1 |
SD |
NA |
NA |
|
乳腺 |
1 |
PD |
NA |
NA |
|
胰腺 |
1 |
SD |
NA |
NA |
NA = 由于数量较少或缺乏缓解而不适用;CR = 完全缓解;PR = 部分缓解;NE = 不可评价;SD = 疾病稳定;PD = 疾病进展。
+ 表示持续缓解。
*数据截止时的观测值,而非范围。
表6 NTRK融合伴侣基因的疗效结果|
NTRK 合作伙伴* |
患者 (N = 55) |
客观缓解率 |
DOR |
|
|
|
|
% |
95% CI |
范围(月) |
|
ETV6-NTRK3 |
25 |
84% |
(64%, 96%) |
3.7, 27.9 + |
|
TPM3-NTRK1 |
9 |
56% |
(21%, 86%) |
3.7, 10.3 + |
|
LMNA-NTRK1 |
5 |
40% |
NA |
5.6, 33.2 + |
|
推断为 ETV6-NTRK3 |
3 |
100% |
(29%, 100%) |
1.4 +、2.7 ** |
|
IRF2BP2-NTRK1 |
2 |
CR、PR |
不适用 |
3.7, 20.3 + |
|
SQSTM1-NTRK1 |
2 |
PR、PR |
不适用 |
9.9, 12.9 + |
|
PDE4DIP-NTRK1 |
1 |
PR |
不适用 |
3.6 + *** |
|
PPL-NTRK1 |
1 |
CR |
不适用 |
12.0 + *** |
|
STRN-NTRK2 |
1 |
PR |
不适用 |
5.6*** |
|
TPM4-NTRK3 |
1 |
CR |
不适用 |
23.6 *** |
|
TPR-NTRK1 |
1 |
PR |
不适用 |
8.2*** |
|
TRIM63-NTRK1 |
1 |
PR |
不适用 |
1.9 + *** |
|
CTRC-NTRK1 |
1 |
SD |
NA |
NA |
|
GON4L-NTRK1 |
1 |
NE |
NA |
NA |
|
PLEKHA6-NTRK1 |
1 |
SD |
NA |
NA |
CR = 完全缓解;PR = 部分缓解;NE = 不可评价;SD = 疾病稳定;NA = 不适用。
+ 表示持续缓解。
*主要分析集中确定的融合伴侣 (N = 55) 可能不代表所有潜在的融合伴侣。
**对于1例在部分缓解后接受切除术且在数据截止时仍无疾病的不可切除婴儿型纤维肉瘤儿童患者,在手术时删失缓解持续时间。
***数据截止时的观测值,不在范围内。基于肿瘤标本中存在 NTRK 基因融合,选择接受 VITRAKVI 治疗的患者。FDA批准的检测信息可参见 http://www.fda.gov/companiondiagnostics
1、推荐剂量
a、体表面积至少为1.0米-平方
VITRAKVI 的推荐剂量为 100 mg 口服给药,每日两次,与或不与食物同服,直至疾病进展或出现不可接受的毒性。
b、体表面积小于1.0米的儿童患者的推荐剂量-平方
VITRAKVI 的推荐剂量为100 mg/m 2,口服,每日两次,与或不与食物同服,直至疾病进展或出现不可接受的毒性。
2、针对不良反应的剂量调整
对于3级或4级不良反应:
a、停用VITRAKVI,直至不良反应消退或改善至基线或1级。如果在4周内消退,则在下一次剂量调整时恢复给药。
b、如果不良反应在4周内未消退,则永久停用VITRAKVI。
针对不良反应的 VITRAKVI 推荐剂量调整见表1。
3次剂量调整后无法耐受 VITRAKVI 的患者永久停用VITRAKVI。
3、与强效 CYP3A4 抑制剂联合给药时的剂量调整
避免强效 CYP3A4 抑制剂与 VITRAKVI 同时给药。如果无法避免同时给予强效 CYP3A4 抑制剂,则将 VITRAKVI 剂量降低50%。停用抑制剂3-5个消除半衰期后,重新开始服用 CYP3A4 抑制剂前服用的 VITRAKVI 剂量 [参见药物相互作用]。
4、与强效 CYP3A4 诱导剂联合给药的剂量调整
避免强效 CYP3A4 诱导剂与 VITRAKVI 同时给药。如果无法避免与强效 CYP3A4 诱导剂联合给药,则将 VITRAKVI 剂量加倍。诱导剂停用3-5个消除半衰期后,在开始 CYP3A4 诱导剂治疗前恢复 VITRAKVI 给药 [参见药物相互作用]。
5、肝损害患者的剂量调整
中度 (Child-Pugh B) 至重度 (Child-Pugh C) 肝损害患者将 VITRAKVI 的起始剂量降低50%[见特殊人群用药]。
6、给药
VITRAKVI 胶囊或口服液可互换使用。
请勿在下次计划给药后6小时内补服漏服的剂量。
如果服用一剂 VITRAKVI 后发生呕吐,请在计划时间服用下一剂。
胶囊
用水整粒吞服胶囊。请勿咀嚼或压碎胶囊。
口服溶液
a、将玻璃瓶装 VITRAKVI 口服液储存在冰箱中。首次开瓶90天后,丢弃任何未使用的 VITRAKVI 口服溶液。
b、在制备用于给药的口服剂量之前,请参阅使用说明书。
(1)骨髓抑制:为剂量限制性毒性,长期大剂量给药时,可使血小板、血红蛋白、白细胞减少,一般发生在用药后的14~21日,停药后3~4周恢复。
(2)胃肠道反应:食欲减退、恶心、呕吐,较DDP(顺铂)轻微。
(3)在常规剂量下,对肝、肾、心脏功能无明显影响。
(4)神经毒性、耳毒性、脱发及头晕等不良反应低于DDP,偶见变态反应。神经毒性是指或趾麻木或麻刺感,有蓄积作用;耳毒性首先发生高频率的听觉丧失,耳鸣偶见。
(5)过敏反应(皮疹或瘙痒,偶见喘鸣),发生于使用后几分钟之内。
(1)使用本品前用生理盐水或5%葡萄糖注射剂10ml溶解,然后用5%葡萄糖注射液250-500ml稀释,静脉滴注半小时或1小时。使用CBP时,虽不必水化,但应鼓励患者多饮水,排尿量保持在每日2000ml左右。
(2)本品溶解后,应在8小时内用完,并避光。
(3)本品只作静脉给药,应避免漏于血管外。
(4)本品应避免与铝化物接触,也不宜与其他药物混合滴注。
(5)用药前及用药期内应定期检查血像、肝肾功能等。
(6)用药期间患者应随访检查听力、神经功能、血液尿素氮、肌酐清除率与血清肌酐测定、红细胞压积、血红蛋白测定、白细胞分类与血小板计数、血清钙、镁、钾、钠含量的测定。

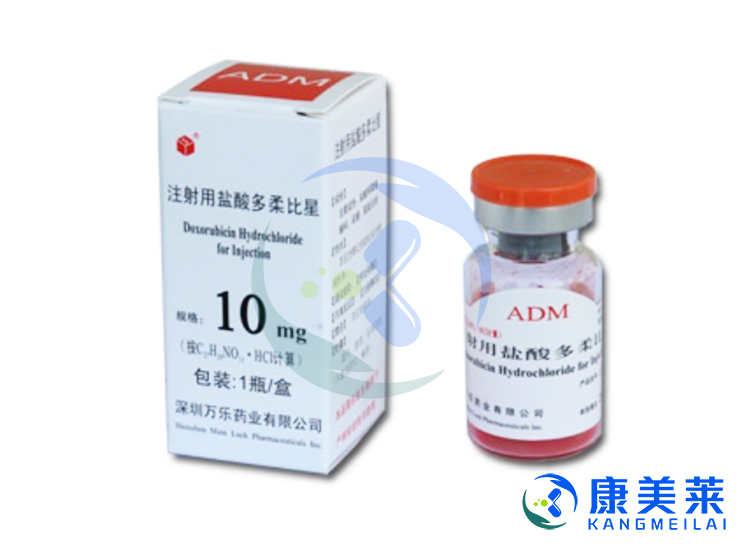
阿霉素(adriamycin)
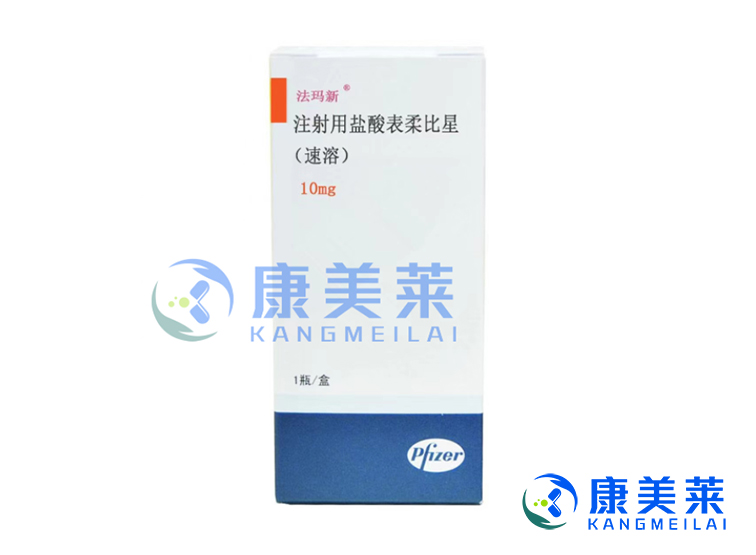
表阿霉素(Epirubicin)
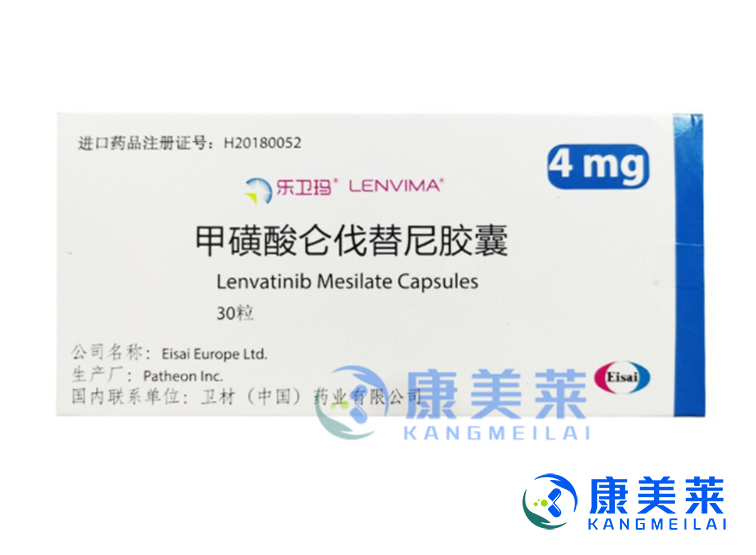
乐伐替尼(仑伐替尼)
索拉非尼(Sorafenib)

卡博替尼(XL184)