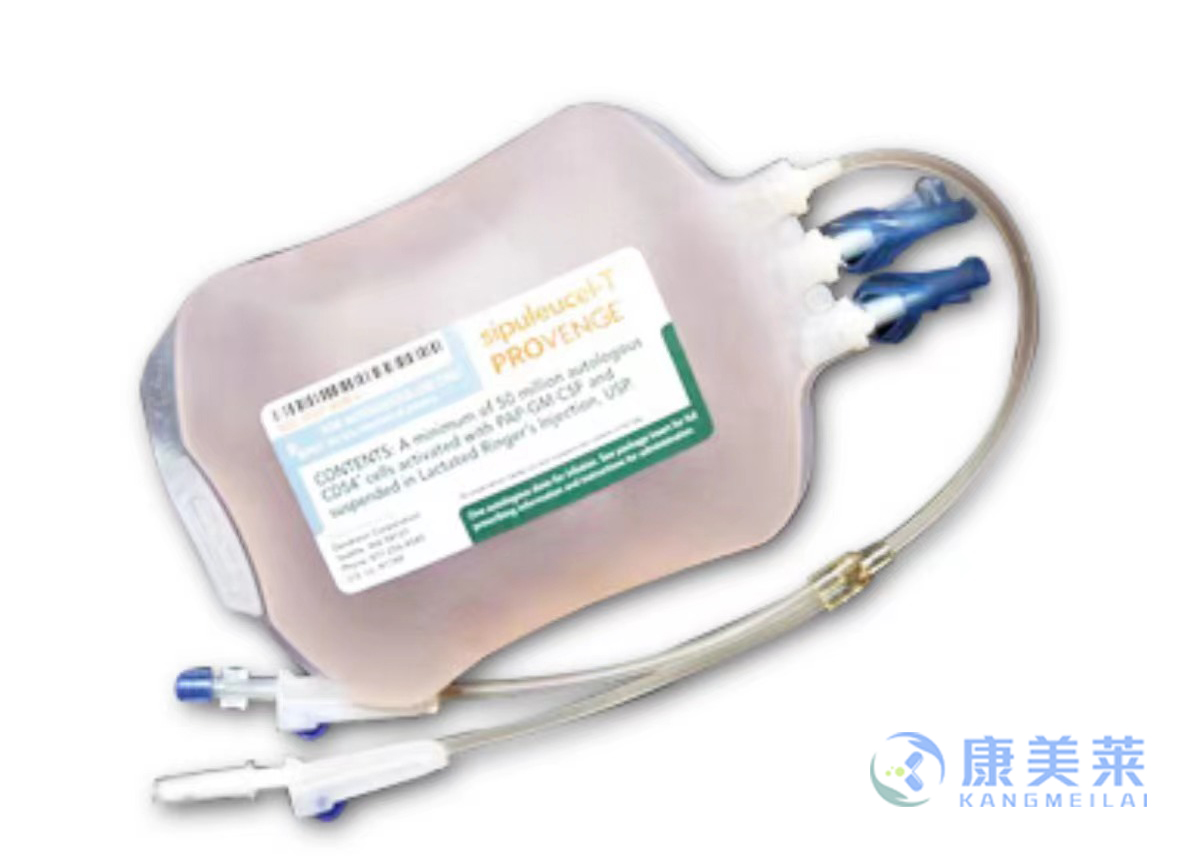
通用名:普罗文奇
商品名:Provenge
全部名称:普罗文奇,Sipuleucel-T,Provenge
用于治疗去势抵抗性(激素难治性)前列腺癌(CRPC),是首个被FDA批准的治疗性肿瘤疫苗。
1、仅供自体使用。仅供静脉注射。
2、以约2周的间隔施用3次剂量。
3、预先给予口服对乙酰氨基酚和抗组胺药如苯海拉明的患者。
4、在输注之前,确认患者的身份与输液袋上的患者标识符相符。
5、在约60分钟内静脉注射PROVENGE。不要使用电池过滤器。
6、急性输液反应的中断或缓慢输注,取决于反应的严重程度。
最常见的不良反应(发生率≥15%)是寒战,疲劳,发烧,背痛,恶心,关节疼痛和头痛。
没有。
1、可能发生急性输液反应。如果发生反应,降低速率或停止输液并进行适当的治疗。
2、还观察到晕厥和低血压。密切监测心脏或肺部病人的病情。
3、血栓栓塞事件危险因素患者应谨慎使用。
4、PROVENGE对传染性传染病没有检测,可能会将疾病传播给处理该产品的保健专业人员。5、应遵循普遍的预防措施。
6、伴随使用化疗和免疫抑制药物与PROVENGE尚未研究。
PROVENGE是250毫升悬浮液,含有在哺乳动物林格注射液USP中用PAP-GM-CSF激活的至少5000万个自体CD54 +细胞。 它在密封的输液袋中提供,标签为特定的接受者。
NDC 30237-8900-6:单个包装在纸箱中的一个袋子。
PROVENGE直接运送到一个装有专用隔热聚氨酯容器的纸板运输箱中的注入供应商。 容器内的隔热容器和凝胶包被设计成保持PROVENGE的适当运输和储存温度,直到输注。
收到后,打开外部纸板装运箱,以验证位于绝热容器顶部的产品和患者专用标签。
不要从运输箱中取出隔热容器,或者打开绝缘容器的盖子,直到患者准备输液。
PROVENGE®是一种新型的自体免疫细胞疗法,它可以激活患者自身的免疫系统对抗肿瘤的发展与转移。其主要有效成分是经过前列腺酸性磷酸酶(PAP)重组蛋白和粒细胞-巨噬细胞集落刺激因子(GM-CSF)重组蛋白激活的抗原递呈细胞。
Dendreon Pharmaceuticals公司在6000多名转移性去势抵抗前列腺(mCRPC)男性患者中进行了一项真实世界研究分析,将细胞疗法PROVENGE(sipuleucel-T)添加到常用处方药物(abiraterone acetate和enzalutamide)中,将患者的死亡风险降低了41%,中位总生存期(OS)延长了14.5个月。
完整说明书详见:https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/8309b497-5d4e-4408-ac0c-2452c11c8a35/spl-doc?hl=Sipuleucel
疗效研究结果:
1、曲普瑞林3.75mg
在一项对277名晚期前列腺癌男性进行的随机、活性对照试验中,研究了TRELSTAR 3.75 mg。患者每月服用TRELSTAR 3.75 mg (N = 140)或经批准的GnRH激动剂,为期9个月。主要疗效终点是在第29天之前完成去势,以及从第57天到第253天维持去势。
去势后血清睾酮水平(≤1.735 nmol/L;相当于50 ng/dL),在137名患者中有125名(91.2%)在第29天和97.7%的患者在第57天达到了3.75 mg。在接受TRELSTAR 3.75 mg治疗的96.2%的患者中,发现从第57天到第253天血清睾酮的去势水平保持不变。
2、曲普瑞林11.25mg
在一项针对346名晚期前列腺癌男性的随机、活性对照试验中研究了TRELSTAR 11.25 mg。患者每12周服用TRELSTAR 11.25 mg (N = 174),共3剂(最长治疗期为253天),或每28天服用TRELSTAR 3.75 mg (N = 172),共9剂。主要疗效终点是在第29天之前完成去势,以及从第57天到第253天维持去势。
去势后血清睾酮水平(≤1.735 nmol/L;相当于50 ng/dL),在171名接受TRELSTAR 11.25 mg治疗的患者中有167名(97.7%)在第29天达到去势水平,在94.4%接受TRELSTAR治疗的患者中发现从第57天到第253天血清睾酮的去势水平保持不变。
3、曲普瑞林22.5mg
TRELSTAR 22.5 mg是在一项针对120名晚期前列腺癌男性的非对比性试验中研究的。患者每24周服用TRELSTAR 22.5 mg (N = 120),共2剂(最长治疗期为337天)。主要疗效终点包括到第29天实现去势,以及从第57天到第337天维持去势。
去势后血清睾酮水平(≤1.735 nmol/L;相当于50 ng/dL),在第29天,97.5%(120人中有117人)接受了22.5mg trel star治疗。从第57天到第337天,93.3%的患者保持去势。
表曲普瑞林临床研究总结
|
产品强度 |
3.75 mg |
11.25 mg |
22.5 mg |
|
患者人数 |
137 |
171 |
120 |
|
治疗方案 |
每4周 |
每12周 |
每24周 |
|
研究期限 |
253天 |
253天 |
337天 |
|
第29天的去势率*,百分比(n/N) |
91.2% (125/137) |
97.7% (167/171) |
97.5% (117/120) |
|
第57–253天的去势维持率,% |
96.2% |
94.4% |
不适用 |
|
第57-337天的去势维持率,% (n/N) |
不适用 |
不适用 |
93.3% (112/120)‡ |
*去势维持量采用频率分布进行计算。
使用生存分析(Kaplan-Meier)技术计算去势的累积维持量。
计算包括5名中止研究但在中止前去势的睾酮水平患者。
曲普瑞林必须在医生的监督下服用。
曲普瑞林通过在任一侧臀部进行单次肌肉注射给药。给药时间表取决于所选的产品强度(表1).将冻干微粒在无菌水中重新配制。不应使用其他稀释剂。
表1TRELSTAR推荐剂量
|
剂量 |
3.75 mg |
11.25 mg |
22.5 mg |
|
推荐剂量 |
每次注射1次 4周 |
每次注射1次 12周 |
每次注射1次 24周 |
由于释放特性不同,剂量强度不是添加剂,必须根据所需的给药方案进行选择。
重建后应立即给予混悬液。
与肌肉注射的其他药物一样,注射部位应定期更换。
在溶液和容器允许的情况下,应在给药前目视检查肠胃外药物产品是否存在颗粒物质和变色。
最常见的不良反应(发生率≥15%)是寒战,疲劳,发烧,背痛,恶心,关节疼痛和头痛。
1、可能发生急性输液反应。如果发生反应,降低速率或停止输液并进行适当的治疗。
2、还观察到晕厥和低血压。密切监测心脏或肺部病人的病情。
3、血栓栓塞事件危险因素患者应谨慎使用。
4、PROVENGE对传染性传染病没有检测,可能会将疾病传播给处理该产品的保健专业人员。应遵循普遍的预防措施。
5、伴随使用化疗和免疫抑制药物与PROVENGE尚未研究。

阿霉素(adriamycin)
表阿霉素(Epirubicin)
甲羟孕酮(MedroxyProgesterone)
顺铂(cisplatin)
戈舍瑞林(Goserelin)