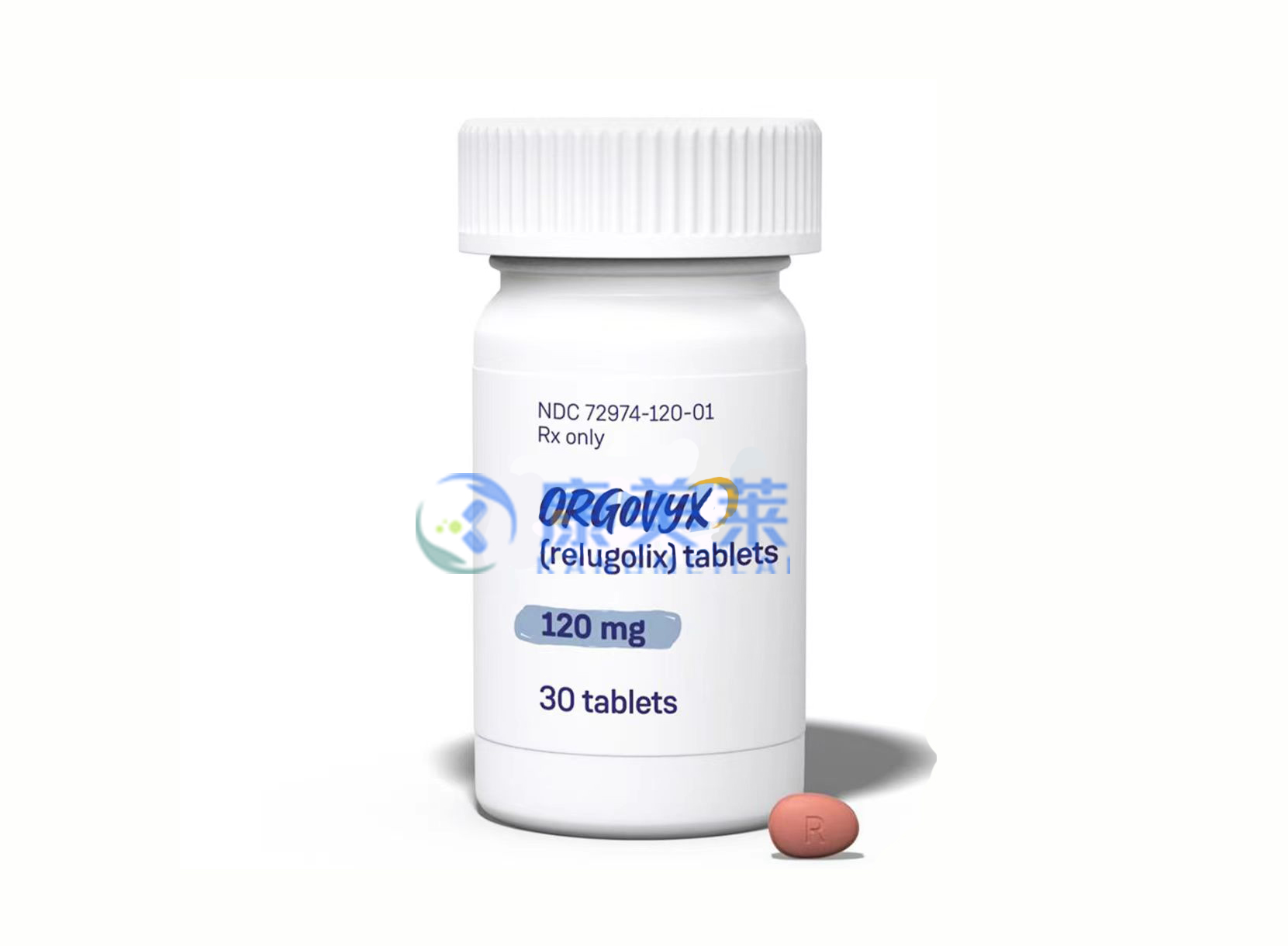
通用名:relugolix
商品名:Orgovyx
全部名称:瑞格列克片,relugolix,Orgovyx
ORGOVYX是促性腺激素释放激素(GnRH)受体激动剂,可用于治疗晚期前列腺癌的成年患者。
建议剂量:治疗第一天的负荷剂量为360mg,然后每天大约一次口服,一次口服120mg。
ORGOVYX可以带或不带食物一起服用。指导患者整个吞服药片,而不要压碎或咀嚼药片。
片剂:120mg
最常见的不良反应(≥10%)和实验室异常(≥15%)为潮红,葡萄糖增加,甘油三酸酯增加,肌肉骨骼疼痛,血红蛋白减少,丙氨酸氨基转移酶(ALT)升高,疲劳,天冬氨酸氨基转移酶(AST)升高,便秘和腹泻。
没有
QT/QTc间隔延长:雄激素剥夺治疗可能会延长QT间隔。
胚胎-胎儿毒性:ORGOVYX可能导致胎儿伤害。与具有生殖潜能的女性伴侣一起使用有效避孕方法。
P-gp抑制剂:避免共同给药。如果不可避免,请先服用ORGOVYX,至少6小时后再单独给药,并进行监测患者较常发生不良反应。
P-gp和强CYP3A诱导剂合用:避免共同给药。如果不可避免,将ORGOVYX剂量增加至每天240mg。
将ORGOVYX存放在室温下。 请勿在30°C(86°F)以上的温度下存放
Relugolix是一种非肽GnRH受体拮抗剂,可与垂体GnRH受体竞争性结合,从而减少促黄体生成激素(LH)和促卵泡激素的释放(FSH),因此是睾丸激素。
2020年12月18日,美国食品药物管理局批准Orgovyx(Relugolix)用于治疗晚期前列腺癌成人患者。
此次美国FD批准Orgovyx(Relugolix)上市是基于一项名为HERO (NCT03085095)的临床研究结果,这是一项针对一年以上去势治疗后复发的晚期前列腺癌患者设计的随机、开放标签的临床试验。
934名符合入组标准的受试患者按2:1的比例随机接受本品或亮丙瑞林微球治疗48周。结果显示:本品治疗组(n=622)至29天至48周的持续去势(睾酮浓度<50ng/dL)率为96.7%,而亮丙瑞林微球组(n=308)为88.8%。Orgovyx治疗组在第8天就已经有91%的患者达到去势标准,而亮丙瑞林微球组为0%。
完整说明书详见:https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/077a92f6-9f1b-479a-87c7-c92b5db6aa9c/spl-doc?hl=relugolix
疗效研究结果:
1、曲普瑞林3.75mg
在一项对277名晚期前列腺癌男性进行的随机、活性对照试验中,研究了TRELSTAR 3.75 mg。患者每月服用TRELSTAR 3.75 mg (N = 140)或经批准的GnRH激动剂,为期9个月。主要疗效终点是在第29天之前完成去势,以及从第57天到第253天维持去势。
去势后血清睾酮水平(≤1.735 nmol/L;相当于50 ng/dL),在137名患者中有125名(91.2%)在第29天和97.7%的患者在第57天达到了3.75 mg。在接受TRELSTAR 3.75 mg治疗的96.2%的患者中,发现从第57天到第253天血清睾酮的去势水平保持不变。
2、曲普瑞林11.25mg
在一项针对346名晚期前列腺癌男性的随机、活性对照试验中研究了TRELSTAR 11.25 mg。患者每12周服用TRELSTAR 11.25 mg (N = 174),共3剂(最长治疗期为253天),或每28天服用TRELSTAR 3.75 mg (N = 172),共9剂。主要疗效终点是在第29天之前完成去势,以及从第57天到第253天维持去势。
去势后血清睾酮水平(≤1.735 nmol/L;相当于50 ng/dL),在171名接受TRELSTAR 11.25 mg治疗的患者中有167名(97.7%)在第29天达到去势水平,在94.4%接受TRELSTAR治疗的患者中发现从第57天到第253天血清睾酮的去势水平保持不变。
3、曲普瑞林22.5mg
TRELSTAR 22.5 mg是在一项针对120名晚期前列腺癌男性的非对比性试验中研究的。患者每24周服用TRELSTAR 22.5 mg (N = 120),共2剂(最长治疗期为337天)。主要疗效终点包括到第29天实现去势,以及从第57天到第337天维持去势。
去势后血清睾酮水平(≤1.735 nmol/L;相当于50 ng/dL),在第29天,97.5%(120人中有117人)接受了22.5mg trel star治疗。从第57天到第337天,93.3%的患者保持去势。
表曲普瑞林临床研究总结
|
产品强度 |
3.75 mg |
11.25 mg |
22.5 mg |
|
患者人数 |
137 |
171 |
120 |
|
治疗方案 |
每4周 |
每12周 |
每24周 |
|
研究期限 |
253天 |
253天 |
337天 |
|
第29天的去势率*,百分比(n/N) |
91.2% (125/137) |
97.7% (167/171) |
97.5% (117/120) |
|
第57–253天的去势维持率,% |
96.2% |
94.4% |
不适用 |
|
第57-337天的去势维持率,% (n/N) |
不适用 |
不适用 |
93.3% (112/120)‡ |
*去势维持量采用频率分布进行计算。
使用生存分析(Kaplan-Meier)技术计算去势的累积维持量。
计算包括5名中止研究但在中止前去势的睾酮水平患者。
曲普瑞林必须在医生的监督下服用。
曲普瑞林通过在任一侧臀部进行单次肌肉注射给药。给药时间表取决于所选的产品强度(表1).将冻干微粒在无菌水中重新配制。不应使用其他稀释剂。
表1TRELSTAR推荐剂量
|
剂量 |
3.75 mg |
11.25 mg |
22.5 mg |
|
推荐剂量 |
每次注射1次 4周 |
每次注射1次 12周 |
每次注射1次 24周 |
由于释放特性不同,剂量强度不是添加剂,必须根据所需的给药方案进行选择。
重建后应立即给予混悬液。
与肌肉注射的其他药物一样,注射部位应定期更换。
在溶液和容器允许的情况下,应在给药前目视检查肠胃外药物产品是否存在颗粒物质和变色。
最常见的不良反应(≥10%)和实验室异常(≥15%)为潮红,葡萄糖增加,甘油三酸酯增加,肌肉骨骼疼痛,血红蛋白减少,丙氨酸氨基转移酶(ALT)升高,疲劳,天冬氨酸氨基转移酶(AST)升高,便秘和腹泻。
QT/QTc间隔延长:雄激素剥夺治疗可能会延长QT间隔。
胚胎-胎儿毒性:ORGOVYX可能导致胎儿伤害。与具有生殖潜能的女性伴侣一起使用有效避孕方法。
P-gp抑制剂:避免共同给药。如果不可避免,请先服用ORGOVYX,至少6小时后再单独给药,并进行监测患者较常发生不良反应。
P-gp和强CYP3A诱导剂合用:避免共同给药。如果不可避免,将ORGOVYX剂量增加至每天240mg。

阿霉素(adriamycin)
表阿霉素(Epirubicin)
甲羟孕酮(MedroxyProgesterone)
顺铂(cisplatin)
戈舍瑞林(Goserelin)