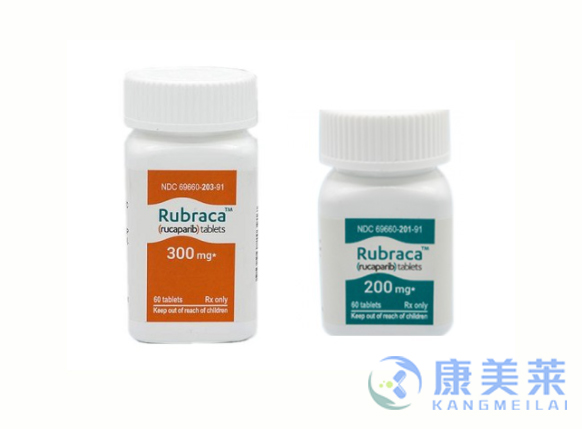
通用名:卢卡帕利
商品名:Rubraca
全部名称:卢卡帕利,卢卡帕尼,鲁卡帕尼,雷卡帕尼,rucaparib,Rubraca
用于治疗既往接受二线治疗药物失败的 BRCA 突变晚期卵巢癌患者。
用于治疗接受过雄激素受体(AR)导向治疗和紫杉烷化疗、携带有害BRCA突变(生殖系和/或体细胞)相关的mCRPC(转移性去势抵抗性前列腺癌)成人患者。
推荐剂量为600毫克(两片300毫克片剂),每天口服两次,与或不与食物同食。
继续治疗直至疾病进展或不可接受毒性。
对不良反应,考虑治疗中断或减低剂量。
最常见不良反应(≥ 20%)为恶心,疲乏(包括无力),呕吐,贫血,腹痛,味觉障碍,便秘,食欲减退,腹泻,血小板减少,和呼吸困难。
最常见实验室异常(≥ 35%)为肌酐增加, ALT增加,AST增加,血红蛋白减低,淋巴细胞减低,胆固醇增加,血小板减低,和嗜中性计数绝对值减低。
无。
1、骨髓增生异常综合征/急性髓性白血病(MDS/AML):在暴露于RUBRACA患者发生MDS/AML,包括一个AML致命性事件。在基线时和其后每月监视患者血液学毒性。如被确证MDS/AML终止。
2、胚胎-胎儿毒性:RUBRACA可能致胎儿伤害。劝告有生殖潜能女性对胎儿潜在风险和使用有效避孕。
3、开始鲁卡帕尼治疗前,请一定要告诉你的医生有关任何你正在服用其他药物(包括处方药,过度的柜台,维生素,草药等)。
4、除非您的医生明确允许,否则请勿服用阿司匹林或含有阿司匹林的产品。
5、服用鲁卡帕尼时,未经医生许可,请勿接受任何形式的免疫接种。
6、对于男性和女性:服用避孕药,服用鲁卡帕尼时不要怀胎(怀孕)。建议在最后一次服用鲁卡帕尼后最长6个月内不要怀孕。
7、服用鲁卡帕尼时以及最终剂量后2周内请勿母乳喂养。
贮存在20°C至25°C(68°F至77°F);外出允许至15°C至30°C(59°F至86°F)
Rucaparib是聚(ADP-核糖)聚合酶(PARP)酶一个的抑制剂,包括PARP-1,PARP-2,和PARP-3,它们在DNA修复中起作用。体外研究曽显示rucaparib-诱导细胞毒性可能涉及PARP酶学活性的抑制作用和增加PARP-DNA复合物的形成导致DNA损伤,凋亡,和细胞死亡。观察到在BRCA1/2和其他DNA修复基因有缺陷肿瘤细胞系增加rucaparib-优点的细胞毒性。Rucaparib在BRCA中有或无缺陷的人癌症的小鼠异种移植模型中曽被显示减低肿瘤生长。
研究表明PARP抑制剂单药治疗可明显抑制可对于BRCA1和BRCA2突变的的卵巢癌细胞活性。ARIEL3是一项评估卢卡帕利维持治疗铂敏感复发性卵巢癌疗效及安全性的的Ⅲ期临床研究,初步结果已显示卢卡帕利可显著提高患者的的无进展生存期(PFS)。
结果显示:
1、ITT人群:卢卡帕利组QA-PFS和Q-TwiST均明显优于安慰剂组(12.2个月vs5.74个月;13.3个月vs6.44个月)。
2、BRCA突变人群:卢卡帕利组QA-PFS和Q-TwiST均明显优于安慰剂组(15.28个月vs5.92个月;16.42个月vs6.70个月)。
3、HRD人群:卢卡帕利组QA-PFS和Q-TwiST均明显优于安慰剂组(13.83个月vs5.90个月;14.9个月vs6.80个月)。
4、BRCA野生型/LOH高人群:卢卡帕利组QA-PFS和Q-TwiST均明显优于安慰剂组(12.6个月vs5.95个月;12.86个月vs6.79个月)。
5、BRCA野生型/LOH低人群:卢卡帕利组QA-PFS和Q-TwiST均明显优于安慰剂组(8.13个月vs5.42个月;9.38个月vs6.03个月)。
6、BRCA野生型/LOH不确定人群:卢卡帕利组QA-PFS和Q-TwiST均明显优于安慰剂组(11.2个月vs3.70个月;13.06个月vs4.45个月)。
Rubraca是第一个被批准用于治疗前列腺癌的PARP抑制剂。此次批准基于多中心、单臂TRITON2临床试验的客观缓解率(ORR)和缓解持续时间(DOR)数据。针对该适应症的持续批准,将取决于验证性试验中临床益处的验证和描述。TRITON3临床试验预计将作为芦卡帕利/卢卡帕尼(Rubraca)加速批准mCRPC的验证性试验。
盲法IRR评估的结果显示,在携带有害BRCA突变的可评估患者中(1)确认的ORR为44%(N=62;95%CI:31-57);在携带生殖系BRCA突变和体细胞BRCA突变的患者中,观察到的ORR相似。(2)在数据截止时,中位DOR不可评估(范围:1.7-24.0+月;95%CI:6.4,NE);在27例(56%)病情实现客观缓解的患者中,有15例DOR≥6个月。
完整说明书详见:https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/a6d46c03-bb1d-417b-b8e5-3bffe352fe29/spl-doc?hl=rucaparib
患者接受ELAHERE 6 mg/kg(基于调整后的理想体重)静脉输注,每3周一次,直至疾病进展或出现不可接受的毒性。前36周每6周进行一次肿瘤缓解评估,此后每12周进行一次。
主要疗效结局指标为研究者根据实体瘤疗效评价标准 (RECIST) 第1.1版评估的总缓解率 (ORR) 和缓解持续时间 (DOR)。
疗效结果如下表
|
|
ELAHERE(N = 104) |
|
确认的总缓解率* (95% CI) |
31.7% (22.9, 41.6) |
|
完全缓解率 |
4.8% |
|
部分缓解率 |
26.9% |
|
缓解持续时间 |
N = 33 |
|
中位缓解持续时间,月 (95% CI) |
6.9 (5.6, 9.7) |
1、推荐剂量
ELAHERE 的推荐剂量为 6 mg/kg 调整后的理想体重 (AIBW),每3周(21天周期)静脉输注一次,直至疾病进展或出现不可接受的毒性。
使用以下公式,根据每例患者的 AIBW 计算 ELAHERE 的总剂量:
AIBW = 理想体重 (IBW[kg]) + 0.4*(实际体重 [kg] –IBW)女性IBW(kg) = 0.9*身高 (cm) –92
2、术前用药和所需的眼部护理
前驱用药
在每次输注 ELAHERE 前给予表1中的前驱用药,以降低输注相关反应 (IRR)、恶心和呕吐的发生率和严重程度。
表1:每次 ELAHERE 输注前的前驱用药
|
前驱用药 |
给药途径 |
示例(或等同) |
ELAHERE 输注前的给药时间 |
|
皮质类固醇 |
静脉内 |
地塞米松 10 mg |
至少 30 min 前 |
|
抗组胺药 |
口服或静脉给药 |
苯海拉明 25 mg-50 mg |
|
|
解热药 |
口服或静脉给药 |
对乙酰氨基酚 325 mg-650 mg |
|
|
止吐药 |
口服或静脉给药 |
5-HT3 血清素受体拮抗剂或适当的替代药物 |
每次给药前和之后根据需要 |
对于发生 IRR 的患者,考虑在 ELAHERE 给药前一天使用额外的前驱用药,包括皮质类固醇。
眼科检查和术前用药
眼科检查:在开始 ELAHERE 治疗前、前8个周期每隔一个周期以及有临床指征时进行眼科检查,包括视力和裂隙灯检查。
眼用局部类固醇:建议使用眼用局部类固醇。任何皮质类固醇药物的初始处方和更新应仅在裂隙灯检查后进行。
从每次输注前一天开始,每只眼睛给予1滴眼用局部类固醇,每日6次,直至第4天;然后在每个 ELAHERE 周期的第5-8天,每只眼睛给予1滴,每日4次 [参见警告和注意事项]。
润滑滴眼液:在 ELAHERE 治疗期间,建议每天至少使用4次润滑滴眼液。指导患者使用润滑滴眼液,并建议在眼部局部类固醇给药后至少等待 10 min 再滴入润滑滴眼液 [参见警告和注意事项]。
3、剂量调整
表2提供了不良反应的剂量减少和调整。调整给药时间表,使两次给药之间间隔3周。
表2:减量方案
|
|
ELAHERE 剂量水平 |
|
起始剂量 |
6 mg/kg AIBW |
|
首次剂量降低 |
5 mg/kg AIBW |
|
第二次剂量降低 |
4 mg/kg AIBW * |
*不能耐受 4 mg/kg AIBW 的患者永久停药。
最常见不良反应(≥ 20%)为恶心,疲乏(包括无力),呕吐,贫血,腹痛,味觉障碍,便秘,食欲减退,腹泻,血小板减少,和呼吸困难。
最常见实验室异常(≥ 35%)为肌酐增加, ALT增加,AST增加,血红蛋白减低,淋巴细胞减低,胆固醇增加,血小板减低,和嗜中性计数绝对值减低。
骨髓增生异常综合征/急性髓性白血病(MDS/AML):在暴露于RUBRACA患者发生MDS/AML,包括一个AML致命性事件。在基线时和其后每月监视患者血液学毒性。如被确证MDS/AML终止。
胚胎-胎儿毒性:RUBRACA可能致胎儿伤害。劝告有生殖潜能女性对胎儿潜在风险和使用有效避孕。
开始鲁卡帕尼治疗前,请一定要告诉你的医生有关任何你正在服用其他药物(包括处方药,过度的柜台,维生素,草药等)。
除非您的医生明确允许,否则请勿服用阿司匹林或含有阿司匹林的产品。
服用鲁卡帕尼时,未经医生许可,请勿接受任何形式的免疫接种。
对于男性和女性:服用避孕药,服用鲁卡帕尼时不要怀胎(怀孕)。建议在最后一次服用鲁卡帕尼后最长6个月内不要怀孕。
服用鲁卡帕尼时以及最终剂量后2周内请勿母乳喂养。

阿霉素(adriamycin)
表阿霉素(Epirubicin)

氟尿嘧啶(5-Fluorouracil)

米托蒽醌(Mitoxantrone)
卡铂(Carboplatin)