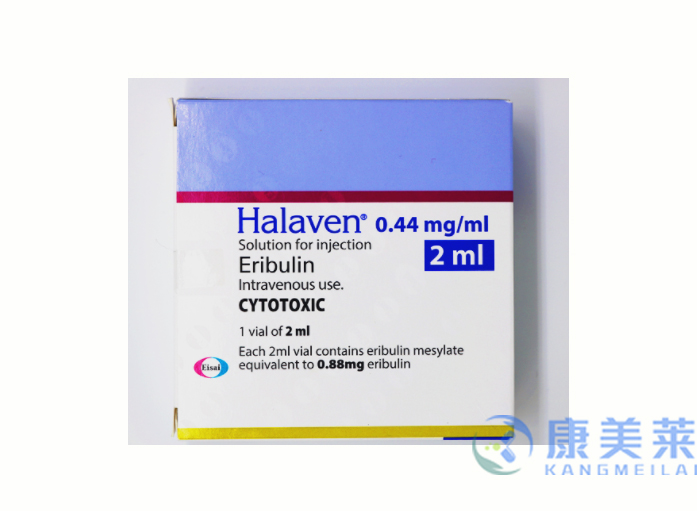
通用名:甲磺酸艾瑞布林
商品名称:Halaven
全部名称:甲磺酸艾瑞布林,艾日布林,Halaven,eribulin mesylate
①转移性乳腺癌(先前接受过至少两种化学疗法治疗转移性疾病的患者);
②无法切除或转移的脂肪肉瘤(先前接受过蒽环类药物治疗的患者)
1、转移性乳腺癌
在21天周期的第1天和第8天,2-5分钟内静脉注射1.4 mg /m²
2、脂肪肉瘤
在21天周期的第1天和第8天,2-5分钟内静脉注射1.4 mg /m²
一、> 10%
1、中性粒细胞减少症(82%),贫血(58%),虚弱/疲劳(54%)
2、脱发(45%),周围神经病变(35%),恶心(35%)
3、便秘(25%),关节痛/肌痛(22%)发热(21%)
4、体重减轻(21%),厌食(20%),头痛(19%)
5、呕吐(18%),腹泻(18%),背痛(16%),肢体疼痛(11%)
6、呼吸困难(16%),咳嗽(14%),骨痛(12%),尿路感染(10%)
二、1-10%
1、流泪增加,消化不良,腹痛,口腔炎
2、口干症,URI,低钾血症,肌肉痉挛/虚弱
3、味觉障碍,头晕,失眠,萧条,皮疹
三、上市后报告
1、胃肠道疾病:胰腺炎
2、血液和淋巴系统疾病:淋巴细胞减少
3、肝胆疾病:肝毒性
4、免疫系统疾病:药物超敏反应
5、感染和感染:肺炎,败血症/中性粒细胞减少
6、代谢和营养失调:低镁血症,脱水
7、呼吸,胸和纵隔疾病:间质性肺疾病
8、皮肤和皮下组织疾病:瘙痒,史蒂文斯-约翰逊综合征,中毒性表皮坏死
未知
1、每次给药前监测周围神经病变
2、报告严重中性粒细胞减少;在每次服药之前监测全血细胞计数;增加发生3级或4级血细胞减少的患者的监测频率; 持续超过7天的发热性中性粒细胞减少或4级中性粒细胞减少的患者延迟治疗并减少后续剂量
3、如果ANC <1,000 /m³,血小板<75,000 /m³或3-4级非血液学毒性,请延迟给药和/或降低剂量
4、小心CHF,心律失常和先天性长QT综合征(监测QT延长);服药前纠正低钾血症或低镁血症
5、与其他延长QT间隔的药物(例如Ia或III类抗心律不齐药,硫代哒嗪,红霉素)合用时,可能引起加成效应
6、根据动物研究及其作用机理,与具有生殖潜能的女性伴侣一起使用于孕妇或男性时,可能对胎儿造成伤害
1、在室温下未稀释的eribulin可储存在注射器中长达4小时,或冷藏在(40°F或/4°C)下可储存长达24小时
2、在室温下将稀释的eribulin溶液最多保存4小时,或者在冷藏(40°F或/4°C)下最多保存24小时
Halaven(甲磺酸艾力布林)是一种非紫杉烷微管动力学抑制剂。它是从海洋海绵鼠笼中分离出的产品芦丁素B的合成类似物。依立布林抑制微管的生长期而不影响其缩短期,并将微管蛋白螯合为非生产性聚集体。Eribulin通过基于微管蛋白的抗有丝分裂机制发挥作用,导致G2 / M细胞周期阻滞,有丝分裂纺锤体破裂,并最终导致有丝分裂长期受阻后凋亡细胞死亡。
FDA对Halaven的批准是基于一项针对762名转移性乳腺癌患者的开放标签,随机,多中心试验,这些患者接受了至少两种化疗方案,并且在其最后一次化疗方案后六个月内经历了疾病进展。将受试者随机分组接受Halaven(n=508)或在随机分组之前选择的单药治疗(n=254)。
根据地理区域,HER2/neu状态和以前的卡培他滨暴露情况对随机分组进行分层。在21天周期的第1天和第8天,以1.4mg/m2的剂量施用Halaven。接受Halaven治疗的患者接受了5个疗程的中位数治疗。对照组的治疗包括97%的化疗和3%的激素治疗。主要疗效结果是总体生存率。
在Halaven组与安慰剂组之间,观察到总体存活率有统计学上的显着改善:在Halaven组中508名受试者死亡274例死亡,而在对照组中254名受试者中148例死亡(p=0.041)。当观察到77%的事件且与主要分析一致(分别为386例与203例死亡)时,进行了更新的,计划外的生存分析。
根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。分别有203人死亡)。根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。分别有203人死亡)。根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。
完整说明书详见:https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/31ce4750-ded5-4a0b-95e9-f229fa6bc822/spl-doc?hl=eribulin
一个药品的获批,往往需要多个临床试验来证实它的治疗效果。那么甲磺酸艾瑞布林的治疗效果怎么样呢?
FDA对Halaven的批准是基于一项针对762名转移性乳腺癌患者的开放标签,随机,多中心试验,这些患者接受了至少两种化疗方案,并且在其最后一次化疗方案后六个月内经历了疾病进展。
将受试者随机分组接受Halaven(n=508)或在随机分组之前选择的单药治疗(n=254)。根据地理区域,HER2/neu状态和以前的卡培他滨暴露情况对随机分组进行分层。在21天周期的第1天和第8天,以1.4mg/m2的剂量施用Halaven。接受Halaven治疗的患者接受了5个疗程的中位数治疗。对照组的治疗包括97%的化疗和3%的激素治疗。主要疗效结果是总体生存率。
在Halaven组与安慰剂组之间,观察到总体存活率有统计学上的显着改善:在Halaven组中508名受试者死亡274例死亡,而在对照组中254名受试者中148例死亡(p=0.041)。当观察到77%的事件且与主要分析一致(分别为386例与203例死亡)时,进行了更新的,计划外的生存分析。
根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。分别有203人死亡)。根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。分别有203人死亡)。根据RECIST标准,Halaven组的客观缓解率为11%,中位缓解持续时间为4.2个月。
我们患者治病首先要选择正确的药品,再者选择正确的药还要有正确的使用方法才能达到最佳的治疗效果。那么甲磺酸艾瑞布林该怎么使用呢?
推荐剂量
1、在21天周期的第1天和第8天,在2至5分钟内静脉内给予HALAVEN的推荐剂量为1.4 mg/m 2。
2、在21天周期的第1天和第8天,在2至5分钟内静脉内给予轻度肝功能不全(Child-Pugh A)患者的HALAVEN推荐剂量为1.1 mg/m2。
3、在21天周期的第1天和第8天,在2至5分钟内静脉注射中度肝功能不全(Child-Pugh B)患者的HALAVEN推荐剂量为0.7 mg/m2 。
4、在21天周期的第1天和第8天,在2至5分钟内静脉注射中度或重度肾功能不全(肌酐清除率(CLcr)15-49 mL / min)的HALAVEN推荐剂量为1.1 mg/m2。
更多关于甲磺酸艾瑞布林的最新资讯请咨询医伴旅。
是药三分毒,虽然甲磺酸艾瑞布林的治疗效果有目共睹,但是在使用的过程中也会出现一定的不良反应。小编在这里给大家整理了一些关于甲磺酸艾瑞布林的副作用:
一、> 10%
1、中性粒细胞减少症(82%),贫血(58%),虚弱/疲劳(54%)
2、脱发(45%),周围神经病变(35%),恶心(35%)
3、便秘(25%),关节痛/肌痛(22%)发热(21%)
4、体重减轻(21%),厌食(20%),头痛(19%)
5、呕吐(18%),腹泻(18%),背痛(16%),肢体疼痛(11%)
6、呼吸困难(16%),咳嗽(14%),骨痛(12%),尿路感染(10%)
二、1-10%
1、流泪增加,消化不良,腹痛,口腔炎
2、口干症,URI,低钾血症,肌肉痉挛/虚弱
3、味觉障碍,头晕,失眠,萧条,皮疹
三、上市后报告
1、胃肠道疾病:胰腺炎
2、血液和淋巴系统疾病:淋巴细胞减少
3、肝胆疾病:肝毒性
4、免疫系统疾病:药物超敏反应
5、感染和感染:肺炎,败血症/中性粒细胞减少
6、代谢和营养失调:低镁血症,脱水
7、呼吸,胸和纵隔疾病:间质性肺疾病
8、皮肤和皮下组织疾病:瘙痒,史蒂文斯-约翰逊综合征,中毒性表皮坏死
我们在使用甲磺酸艾瑞布林的过程中有哪些注意事项呢?小编在这里为大家科普关于甲磺酸艾瑞布林的注意事项:
1、每次给药前监测周围神经病变
2、报告严重中性粒细胞减少;在每次服药之前监测全血细胞计数;增加发生3级或4级血细胞减少的患者的监测频率; 持续超过7天的发热性中性粒细胞减少或4级中性粒细胞减少的患者延迟治疗并减少后续剂量
3、如果ANC <1,000 /m³,血小板<75,000 /m³或3-4级非血液学毒性,请延迟给药和/或降低剂量
4、小心CHF,心律失常和先天性长QT综合征(监测QT延长);服药前纠正低钾血症或低镁血症 与其他延长QT间隔的药物(例如Ia或III类抗心律不齐药,硫代哒嗪,红霉素)合用时,可能引起加成效应
5、根据动物研究及其作用机理,与具有生殖潜能的女性伴侣一起使用于孕妇或男性时,可能对胎儿造成伤害

癌症疫苗
阿霉素(adriamycin)
表阿霉素(Epirubicin)

氟尿嘧啶(5-Fluorouracil)

米托蒽醌(Mitoxantrone)