
通用名:卡培他滨
商品名:希罗达
全部名称:希罗达,卡培他滨,恒瑞,Capecitabine,Xeloda
主要用于晚期乳腺癌、大肠癌,可作为蒽环类和紫杉类治疗失败后的乳腺癌解救治疗。
卡培他滨单药的推荐剂量为1250mg/m2,每日2次口服(早晚各1次;等于每日总剂量2500mg/m2),治疗2周后停药1周,3周为一个疗程。卡培他滨片剂应在餐后30分钟内用水吞服。
1、腹泻,恶心,呕吐,胃炎。
2、手足综合征,表现为:麻木,感觉迟钝,感觉异常,麻刺感,无痛感和疼痛感,皮肤肿胀和红斑,水疱或严重的疼痛。
3、皮炎和脱发较为常见。
4、常有疲乏、黏膜炎、发热、虚弱、嗜睡,还有头痛、味觉障碍、眩晕、失眠、中性粒细胞减少、贫血、脱水。
1、对本品过敏者禁用。
2、严重骨髓抑制者、严重肝肾功能损害者禁用。
3、妊娠及哺乳期妇女禁用。
1、腹泻:卡培他滨可引起腹泻,有时比较严重。对于出现严重腹泻的患者应给予密切监护,若患者开始出现脱水,应立即补充液体和电解质。在适当的情况下,应及早开始使用标准止泻治疗药物(如洛哌丁胺)。必要时需降低给药剂量。
2、脱水:必须预防脱水,并且在脱水出现时及时纠正。病人出现厌食、虚弱、恶心、呕吐或腹泻时早期即可出现脱水。脱水可能导致急性肾功能衰竭,特别是肾功能不全的患者,或与卡培他滨合并应用肾毒性药物的患者。
在这些情况下,已有肾功能衰竭并导致死亡的报告。当出现2级(或以上)脱水症状时,必须立即停止本品的治疗,同时纠正脱水。直到病人脱水症状消失,且导致脱水的直接原因被纠正和控制后,才可以重新开始本品治疗。
针对此不良事件,调整给药剂量是必要的。已观察到的卡培他滨的心脏毒性与氟尿嘧啶药物类似,包括心肌梗死、心绞痛、心律不齐、心脏停搏、心功能衰竭和心电图改变。既往有冠状动脉疾病史的患者中这些不良事件可能更常见。
3、二氢嘧啶脱氢酶(DPD)缺乏:已将与5-FU相关的罕见的非预期重度毒性(例如口腔炎、腹泻、粘膜炎症、中性粒细胞减少症和神经毒性)归结于DPD活性缺乏。DPD(—种涉及氟尿嘧啶降解的酶)活性低或缺乏患者发生氟尿嘧啶所致重度、危及生命或致死性不良反应的风险增加。
4、尽管DPD缺乏无法准确测定,对于DPYD基因位点有某种纯合性或某种复合杂合性突变的患者(基于实验室检测)会导致DPD活性完全或接近完全缺乏,发生危及生命或致死性毒性的风险最高,故不应接受本品治疗。对于DPD活性完全缺乏的患者,尚未证实任何安全剂量。
5、对于本品获益大于风险(考虑到备选的非氟嘧啶类化疗方案的适合性)的DPD部分缺乏患者,治疗时必须极其谨慎,开始时大幅降低剂量,之后频繁监测,并根据毒性调整剂量。
6、在接受卡培他滨治疗的未能确认DPD缺乏的患者中,可能发生表现为急性药物过量的危及生命毒性。如发生2-4级急性毒性,必须立刻终止治疗。应根据观察到毒性的发生时间、持续时间和严重程度的临床评估考虑永久终止。
7、卡培他滨可以引起严重皮肤反应,如Seven-Johnson综合征和中毒性表皮坏死松解症(TEN)。可能因使用卡培他滨治疗而引发严重皮肤反应的患者,应永久性停用卡培他滨。
8、卡培他滨可引起手足综合征(手掌-足底红肿疼痛或化疗引起肢端红斑),一种皮肤毒性。持续性或严重的手足综合征(2级以上)可最终导致指纹损失,进而可能会影响患者的身份识别。转移性肿瘤患者接受卡培他滨单药治疗,手足综合征出现的中位时间为79天(范围从11到360天),严重程度为1到3级。
9、卡培他滨可引起高胆红素血症。如果药物相关的胆红素升高>3.0×ULN或肝转氨酶(ALT,AST)升高>2.5×ULN,应立即暂停使用卡培他滨。当胆红素降低至≤3.0×ULN或者肝转氨酶≤2.5×ULN,可恢复使用卡培他滨。
10、应严密监测卡培他滨治疗的毒性反应。大多数不良反应是可逆的,虽然剂量可能需要限制或降低,但无需终止用药。
密封,常温(10~30℃)保存。
卡培他滨是一种对肿瘤细胞有选择性活性的口服细胞毒性制剂。卡培他滨本身无细胞毒性,但可转化为具有细胞毒性的5氟尿嘧啶,其结构通过肿瘤相关性血管因子胸苷磷酸化酶在肿瘤所在部位转化而成,从而最大程度的降低了5-氟尿嘧啶对正常人体细胞的损害。
卡培他滨片治疗乳腺癌的效果较好,安全性高。卡培他滨片继承了氟尿嘧啶(5-FU)广谱的抗肿瘤活性,同时又具备了口服化疗安全方便的优越性。卡培他滨是治疗癌症和恶性肿瘤比较流行的药物之一,是由瑞士罗氏公司研制的一种新型选择性靶向口服抗肿瘤药。
目前常与另一种口服化疗药物奥沙利铂联合使用。两者皆为新型的靶向化疗药物。并且,根据临床经验,同时配合中药治疗的话,可以有效的降低该药的副作用,同时提高该药的治疗效果。
为了探讨卡培他滨片(Xeloda)联合多西紫杉醇注射液(Docetaxel)治疗乳腺癌肝转移的临床疗效,做了如下实验。方法20例经蒽环类药物正规化疗后肝转移的乳腺癌患者,采用Xeloda联合Docetaxel治疗。
观察其临床疗效及不良反应。结果20例患者完全缓解6例,部分缓解5例,稳定5例,进展4例,总有效率为55%。随访3年,死亡11例,复发4例,存活5例;平均生存期17.5个月,平均缓解期9.2个月。不良反应主要是骨髓抑制、胃肠道反应、手足综合征。
通过研究表明,卡培他滨片治疗乳腺癌疗效确切,安全性高,值得临床推广,是治疗癌症和恶性肿瘤的重要药物之一。
完整说明书详见:https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/a1de8bba-3b1d-4c9d-ab8a-32d2c05e67c8/spl-doc?hl=Xeloda
KAPEDA 属于 “细胞抑制剂”,可阻止癌细胞的生长。KAPEDA含有500 mg Kapesitabin,它本身不是细胞毒剂(会杀死细胞或停止其功能)。被人体吸收后,在肿瘤细胞内转化为细胞毒药物。KAPEDA 适用于治疗大肠癌、大肠末端(直肠)癌、胃癌或乳腺癌。此外,该药可用于手术完全切除肿瘤后以防止结肠癌复发。KAPEDA 可单独使用或与其他药物联合使用。
1、推荐剂量
ORSERDU 的推荐剂量为345 mg,与食物同服,每日一次,直至发生疾病进展或不可接受的毒性。
每天大致相同的时间服用ORSERDU。与食物同服以减少恶心和呕吐 [见不良反应]。
整片吞服 ORSERDU 片剂。吞咽前请勿咀嚼、压碎或掰开。请勿服用任何破损、裂纹或外观损坏的 ORSERDU 片剂。
如果漏服时间超过6小时或发生呕吐,跳过该剂量,并在第二天的常规计划时间服用下一剂药物。
2、针对不良反应的剂量调整
表1不良反应的 ORSERDU 剂量降低水平
|
剂量减少 |
剂量 |
片剂数量和规格 |
|
首次剂量降低 |
258 mg 每日一次 |
3片 86 mg 片剂 |
|
第二次减量 |
172 mg,每日一次* |
2片 86 mg 片剂 |
*如果需要进一步将剂量降至 172 mg 每日一次以下,则永久停用ORSERDU。
表2不良反应的 ORSERDU 剂量调整指南
|
严重度 |
剂量调整 |
|
1级 |
以当前剂量水平继续 ORSERDU 治疗。 |
|
2级 |
考虑中断 ORSERDU 治疗,直至恢复 至≤1级或基线。然后重新开始 相同剂量水平的ORSERDU。 |
|
3级 |
中断 ORSERDU 治疗,直至恢复至≤1级或基线。然后以下一个较低剂量水平恢复 ORSERDU 治疗。
如果3级毒性复发,则中断 ORSERDU 治疗 直至恢复至≤1级或基线。然后 恢复ORSERDU,降低另一个剂量水平。 |
|
4级 |
中断 ORSERDU 治疗,直至恢复至≤1级或基线。然后降低一个剂量水平重新开始 ORSERDU 治疗。
如果4级或不可耐受的不良反应复发,则永久停用ORSERDU。 |
3、与 CYP3A4 诱导剂和抑制剂合并使用时的剂量调整
避免 ORSERDU 与强效或中效 CYP3A4 诱导剂和抑制剂合并使用
4、肝损害患者的剂量调整
重度肝损害 (Child-Pugh C) 患者避免使用ORSERDU。对于中度肝损害患者 (Child-Pugh B),将 ORSERDU 剂量降低至258 mg,每日一次。轻度肝损伤 (Child-Pugh A) 患者无需调整剂量。
1、腹泻,恶心,呕吐,胃炎。
2、手足综合征,表现为:麻木,感觉迟钝,感觉异常,麻刺感,无痛感和疼痛感,皮肤肿胀和红斑,水疱或严重的疼痛。
3、皮炎和脱发较为常见。
4、常有疲乏、黏膜炎、发热、虚弱、嗜睡,还有头痛、味觉障碍、眩晕、失眠、中性粒细胞减少、贫血、脱水。
1、腹泻:卡培他滨可引起腹泻,有时比较严重。对于出现严重腹泻的患者应给予密切监护,若患者开始出现脱水,应立即补充液体和电解质。在适当的情况下,应及早开始使用标准止泻治疗药物(如洛哌丁胺)。必要时需降低给药剂量。
2、脱水:必须预防脱水,并且在脱水出现时及时纠正。病人出现厌食、虚弱、恶心、呕吐或腹泻时早期即可出现脱水。脱水可能导致急性肾功能衰竭,特别是肾功能不全的患者,或与卡培他滨合并应用肾毒性药物的患者。
在这些情况下,已有肾功能衰竭并导致死亡的报告。当出现2级(或以上)脱水症状时,必须立即停止本品的治疗,同时纠正脱水。直到病人脱水症状消失,且导致脱水的直接原因被纠正和控制后,才可以重新开始本品治疗。
针对此不良事件,调整给药剂量是必要的。已观察到的卡培他滨的心脏毒性与氟尿嘧啶药物类似,包括心肌梗死、心绞痛、心律不齐、心脏停搏、心功能衰竭和心电图改变。既往有冠状动脉疾病史的患者中这些不良事件可能更常见。
3、二氢嘧啶脱氢酶(DPD)缺乏:已将与5-FU相关的罕见的非预期重度毒性(例如口腔炎、腹泻、粘膜炎症、中性粒细胞减少症和神经毒性)归结于DPD活性缺乏。DPD(—种涉及氟尿嘧啶降解的酶)活性低或缺乏患者发生氟尿嘧啶所致重度、危及生命或致死性不良反应的风险增加。
4、尽管DPD缺乏无法准确测定,对于DPYD基因位点有某种纯合性或某种复合杂合性突变的患者(基于实验室检测)会导致DPD活性完全或接近完全缺乏,发生危及生命或致死性毒性的风险最高,故不应接受本品治疗。对于DPD活性完全缺乏的患者,尚未证实任何安全剂量。
5、对于本品获益大于风险(考虑到备选的非氟嘧啶类化疗方案的适合性)的DPD部分缺乏患者,治疗时必须极其谨慎,开始时大幅降低剂量,之后频繁监测,并根据毒性调整剂量。
6、在接受卡培他滨治疗的未能确认DPD缺乏的患者中,可能发生表现为急性药物过量的危及生命毒性。如发生2-4级急性毒性,必须立刻终止治疗。应根据观察到毒性的发生时间、持续时间和严重程度的临床评估考虑永久终止。
7、卡培他滨可以引起严重皮肤反应,如Seven-Johnson综合征和中毒性表皮坏死松解症(TEN)。可能因使用卡培他滨治疗而引发严重皮肤反应的患者,应永久性停用卡培他滨。
8、卡培他滨可引起手足综合征(手掌-足底红肿疼痛或化疗引起肢端红斑),一种皮肤毒性。持续性或严重的手足综合征(2级以上)可最终导致指纹损失,进而可能会影响患者的身份识别。转移性肿瘤患者接受卡培他滨单药治疗,手足综合征出现的中位时间为79天(范围从11到360天),严重程度为1到3级。
9、卡培他滨可引起高胆红素血症。如果药物相关的胆红素升高>3.0×ULN或肝转氨酶(ALT,AST)升高>2.5×ULN,应立即暂停使用卡培他滨。当胆红素降低至≤3.0×ULN或者肝转氨酶≤2.5×ULN,可恢复使用卡培他滨。
10、应严密监测卡培他滨治疗的毒性反应。大多数不良反应是可逆的,虽然剂量可能需要限制或降低,但无需终止用药。

癌症疫苗
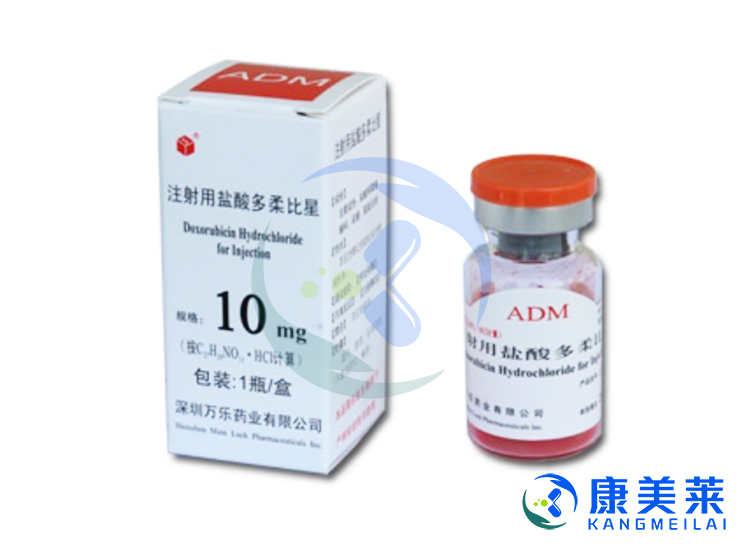
阿霉素(adriamycin)
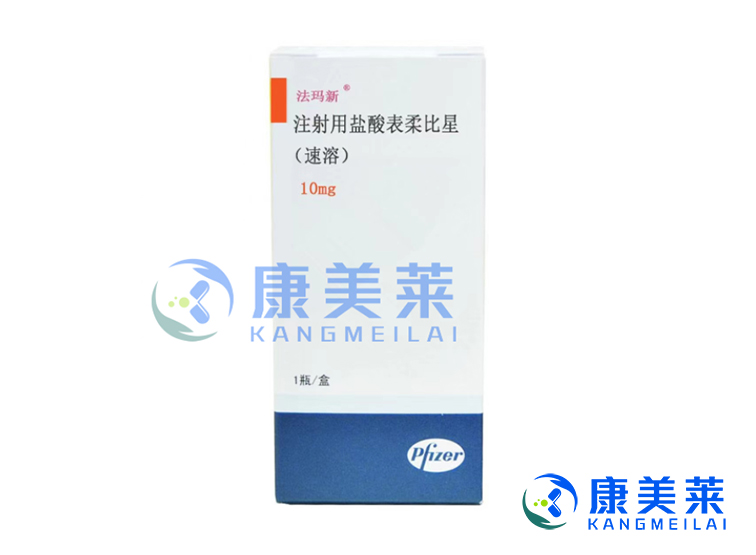
表阿霉素(Epirubicin)

氟尿嘧啶(5-Fluorouracil)

米托蒽醌(Mitoxantrone)