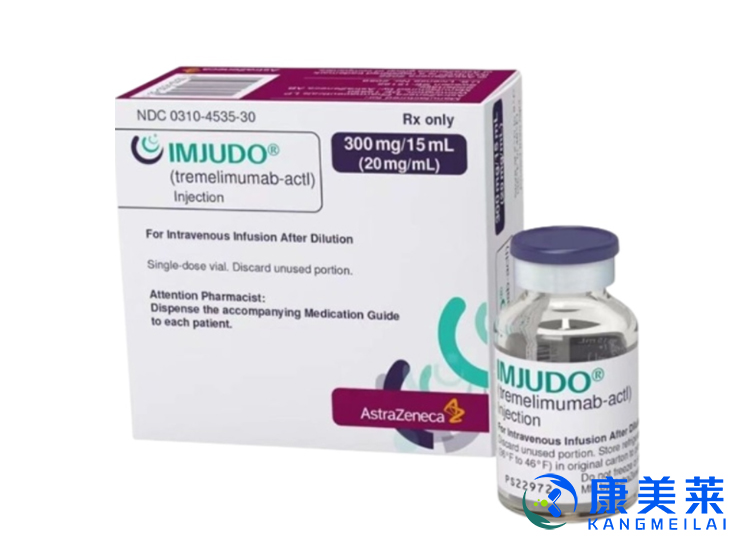
通用名称:tremelimumab-actl
商品名称:IMJUDO
英文名称:Tremelimumab
中文名称:曲美木单抗、替西木单抗
全部名称:曲美木单抗、替西木单抗、tremelimumab-actl、抗CTLA-4单抗、IMJUDO
1、肝细胞癌
曲美木单抗(Tremelimumab,IMJUDO)联合durvalumab(德瓦鲁单抗)适用于治疗不可切除的肝细胞癌 (uHCC) 成人患者。
2、非小细胞肺癌 (NSCLC)
曲美木单抗(Tremelimumab,IMJUDO)联合durvalumab(德瓦鲁单抗)和含铂化疗,适用于治疗无致敏表皮生长因子受体 (EGFR) 突变或间变性淋巴瘤激酶 (ALK) 基因组肿瘤畸变的转移性 NSCLC 成人患者。
注射液:25 mg/1.25 mL(20 mg/mL) 或300 mg/15 mL(20 mg/mL)
1、推荐剂量
曲美木单抗(Tremelimumab,IMJUDO)联合durvalumab(德瓦鲁单抗)治疗不可切除的肝细胞癌 (uHCC) 成人患者见表1
表1:曲美木单抗的推荐剂量
|
适应症 |
曲美木单抗推荐剂量 |
治疗持续时间 |
|
肝细胞癌 (uHCC) |
一、体重≥30 kg的患者: 1、第1周期第1天单次给药曲美木单抗300mg*,随后给予德瓦鲁单抗(durvalumab) 1,500 mg**; 2、继续给予德瓦鲁单抗(durvalumab) 1,500 mg单药治疗,每4周一次 二、体重低于 30 kg 的患者: 1、第1周期第1天单次给药曲美木单抗4 mg/kg*,随后德瓦鲁单抗(durvalumab) 20 mg/kg**; 2、继续给予德瓦鲁单抗(durvalumab)20 mg/kg 单药治疗,每4周一次 |
联合治疗第1周期后,德瓦鲁单抗(durvalumab) 单药给药,每4周一次,直至疾病进展或出现不可接受的毒性 |
*在同一天durvalumab(德瓦鲁单抗)给药前给予曲美木单抗(IMJUDO)
**曲美木单抗(Tremelimumab,IMJUDO)联合durvalumab(德瓦鲁单抗)和含铂化疗
曲美木单抗(Tremelimumab,IMJUDO)治疗转移性非小细胞肺癌 (NSCLC) 的推荐给药方案见表2和表3。
每次输注前称量患者体重。
根据患者体重和肿瘤组织学,使用下表3计算适当剂量。
表2:推荐剂量方案
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
循环: |
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
|
6 |
|
|
|
7 |
|
|
|
8 |
|
IMJUDO 3,4 |
X |
|
|
X |
|
|
X |
|
|
X |
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
Durvalumab 1,3 |
X |
|
|
X |
|
|
X |
|
|
X |
|
|
X |
|
|
|
X |
|
|
|
X |
|
|
|
X |
|
化疗 |
X |
|
|
X |
|
|
X |
|
|
X |
|
|
X5 |
|
|
|
X5 |
|
|
|
X5 |
|
|
|
X5 |
|
周期1,2 |
|||||||||||||||||||||||||
1持续接受 durvalumab 治疗,直至疾病进展或出现不可耐受的毒性。
2从第5周期开始,给药间隔从每3周一次变为每4周一次。
3静脉输注 60 min。
4如果患者接受少于4个周期的铂类药物化疗,则其余周期IMJUDO(最多共5个周期)应在铂类药物化疗期后给药,联合durvalumab,每4周一次。
5对于接受培美曲塞和卡铂/顺铂治疗的非鳞状疾病患者,从第12周开始可选择培美曲塞治疗,直至疾病进展或出现不可耐受的毒性。
表3:推荐方案和剂量
|
肿瘤组织学 |
患者体重 |
IMJUDO 剂量 |
Durvalumab 1 剂量 |
含铂化疗方案1 |
|
非鳞状 |
≥30 kg |
75 mg |
1,500 mg |
1、卡铂和白蛋白结合型紫杉醇 2、卡铂或顺铂和培美曲塞 |
|
< 30 kg |
1 mg/kg |
20 mg/kg |
||
|
鳞状 |
≥30 kg |
75 mg |
1,500 mg |
1、卡铂和白蛋白结合型紫杉醇 2、卡铂或顺铂和吉西他滨 |
|
< 30 kg |
1 mg/kg |
20 mg/kg |
3、针对不良反应的剂量调整
不建议因治疗而减少剂量。一般情况下,如果发生重度(3级)免疫介导的不良反应,暂停治疗方案。如果在开始皮质类固醇治疗后12周内发生危及生命(4级)的免疫介导的不良反应、复发性重度(3级)免疫介导的反应,需要全身免疫抑制治疗,或无法将皮质类固醇剂量减至≤10 mg/天泼尼松或等效药物,则永久终止治疗方案。推荐的治疗调整见表4。
表4:不良反应的推荐剂量调整
ALT = 丙氨酸氨基转移酶,AST = 天冬氨酸氨基转移酶,DRESS = 伴有嗜酸性粒细胞增多和全身症状的药疹,SJS = Stevens Johnson综合征,TEN = 中毒性表皮坏死松解症,ULN = 正常上限
1基于美国国家癌症研究所不良事件通用术语标准4.03版。
2皮质类固醇减量后完全或部分缓解(0-1级)的患者重新开始治疗。如果在开始类固醇治疗后12周内未完全或部分消退,或在开始皮质类固醇治疗后12周内无法将皮质类固醇剂量减至 10 mg 泼尼松或更低剂量/天(或等效药物),则永久停药。
3如果基线时肝脏受累患者的 AST 和ALT≤ULN,则根据无肝脏受累的肝炎建议,暂停或永久停用durvalumab。
制备和给药
准备:
1、目视检查制剂是否存在颗粒物和变色。如果溶液浑浊、变色或观察到可见异物,则丢弃。
2、请勿振摇小瓶。
3、从曲美木单抗(IMJUDO)药瓶中抽取所需体积,并丢弃装有任何未使用部分的药瓶。
4、转移至含有0.9%氯化钠注射液 (USP) 或5%葡萄糖注射液 (USP) 的静脉输液袋中,并稀释至浓度为0.1 mg/mL-10 mg/mL。轻轻翻转,混匀稀释溶液。请勿振摇溶液。
稀释曲美木单抗(IMJUDO)输注溶液的储存
1、曲美木单抗(IMJUDO)不含防腐剂。制备后立即给予输注溶液。如果输注溶液不立即给药且需要储存,则从制备至开始给药的总时间不应超过:
1)2°C-8°C(36°F-46°F) 冰箱中24小时
2)室温高达30℃ (86℉) 下24小时
2、请勿冷冻。
3、请勿振摇。
给药:
1、曲美木单抗(IMJUDO)输注溶液通过含0.2或0.22微米无菌低蛋白结合过滤器的静脉管路在 60 min 内静脉给药。
2、每种制剂使用单独的输液袋和过滤器。
曲美木单抗(IMJUDO)联合其他药物
1、所有药品均单独静脉输注给药。
2、请勿通过同一输液管与其他药物联合给药。
3、关于铂类药物化疗的给药信息,请参阅处方信息。
4、对于培美曲塞治疗,给药信息请参见处方信息。
联合治疗方案:输注顺序
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)
给药顺序:在给药当天输注IMJUDO,随后输注durvalumab。
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗
给药顺序:给药当天首先输注IMJUDO,随后输注durvalumab,然后输注含铂化疗。
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和培美曲塞治疗
给药顺序:给药当天首先输注IMJUDO,随后输注durvalumab,然后输注培美曲塞。
联合治疗方案:输注说明
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)
输注说明:IMJUDO输注完成后观察患者 60 min[参见警告和注意事项]。然后在 60 min 内单独静脉输注 durvalumab。
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗/培美曲塞治疗第1周期:
输注说明:IMJUDO输注1小时。IMJUDO输注完成后1-2小时,在1小时内输注durvalumab。durvalumab输注完成后1-2小时,给予铂类药物化疗。
后续周期:如果在周期1期间没有输注反应,后续周期的 durvalumab 可以在 IMJUDO 给药后立即给药。durvalumab输注结束和化疗开始之间的时间可以缩短至30 min。
一、只接受曲美木单抗(IMJUDO)治疗的常见不良反应:
1、恶心 (37%)、食欲减退 (25%) 和疲乏 (22%)。
2、最常见的3级或4级 (> 10%) 实验室检查异常为:
1)中性粒细胞减少症 (39%)、白细胞减少症 (21%)、淋巴细胞减少症(20%)
2)贫血 (20%)、低钠血症 (14%)、脂肪酶升高 (12%) 和血小板减少症 (11%)
二、曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗肝细胞癌常见不良反应:
1、胃肠道疾病:腹泻、腹痛、恶心
2、皮肤及皮下组织类疾病:皮疹、瘙痒
3、代谢及营养类疾病:食欲减退
4、全身性疾病及给药部位各种反应:疲乏、发热
5、精神疾病:失眠
6、内分泌系统疾病:甲状腺功能减退症
7、各种肌肉骨骼及结缔组织疾病:肌肉骨骼疼痛
三、曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗治疗非小细胞肺癌常见不良反应:
1、呼吸系统、胸及纵隔疾病:咳嗽、咳痰
2、胃肠道疾病:恶心、腹泻、便秘、呕吐、口腔炎
3、内分泌系统疾病:甲状腺功能减退症
4、皮肤及皮下组织类疾病:皮疹、脱发、瘙痒
5、全身性疾病及给药部位各种反应:疲乏、乏力、发热、水肿
6、各种肌肉骨骼及结缔组织疾病:肌肉骨骼疼痛
7、代谢及营养类疾病:食欲减退
8、感染及侵染类疾病:感染性肺炎、上呼吸道感染
9、神经系统疾病:头痛
最常见3级或4级实验室检查异常为:
1、中性粒细胞减少症、贫血、白细胞减少症、淋巴细胞减少症
2、脂肪酶升高、低钠血症和血小板减少症。
1、免疫介导的重度和致死性不良反应
曲美木单抗(IMJUDO)是一种单克隆抗体,可阻断 CTLA-4 通路诱导的 T 细胞抑制信号,从而消除对免疫应答的抑制。与 PD-L1 抑制剂德瓦鲁单抗(Durvalumab)联合使用,这些药物有可能诱导免疫介导的不良反应。此处列出的免疫介导不良反应可能不包括所有可能的重度和致死性免疫介导反应。
任何器官系统或组织均可能发生免疫介导的不良反应,可能为重度或致死性。免疫介导的不良反应可发生在曲美木单抗(IMJUDO)与 德瓦鲁单抗(Durvalumab)联合治疗开始后的任何时间。虽然免疫介导的不良反应通常在治疗期间出现,但曲美木单抗(IMJUDO)和/或德瓦鲁单抗(Durvalumab)停药后也可能出现免疫介导的不良反应。
1)免疫介导性肺炎
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的肺炎,可能是致命的。
IMJUDO 联合 Durvalumab和含铂化疗
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中3.5%(21/596) 发生免疫介导的肺炎,包括致死性 (0.5%) 和3级 (1%) 不良反应。
2)免疫介导的结肠炎
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗的患者中有6%(23/388) 发生免疫介导的结肠炎或腹泻,包括3级 (3.6%) 不良反应。
IMJUDO 联合 Durvalumab和含铂化疗
IMJUDO 联合 durvalumab 和含铂化疗可引起免疫介导的结肠炎,可能具有致死性。
3)免疫介导的肝炎
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的肝炎,可能是致命的。
IMJUDO 联合 Durvalumab和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的3.9%(23/596) 患者发生免疫介导的肝炎,包括致死性 (0.3%)、4级 (0.5%) 和3级 (2%) 不良反应。
4)免疫介导的内分泌病
肾上腺功能不全:
IMJUDO 联合 Durvalumab
1.5%(6/388) 接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗的患者发生免疫介导的肾上腺功能不全,包括3级 (0.3%) 不良反应。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,2.2%(13/596) 发生免疫介导的肾上腺功能不全,包括3级 (0.8%) 不良反应。
垂体炎:
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的垂体炎。
IMJUDO 联合 Durvalumab 和含铂化疗
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中1.3%(8/596) 发生免疫介导的垂体炎,包括3级 (0.5%) 不良反应。
甲状腺疾病:
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的甲状腺疾病。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,1.2%(7/596) 发生免疫介导的甲状腺炎。
甲状腺功能亢进症:
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗的患者发生免疫介导的甲状腺功能亢进,包括3级 (0.3%) 不良反应。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中5%(30/596) 发生免疫介导的甲状腺功能亢进,包括3级 (0.2%) 不良反应。
甲状腺功能减退:
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)联合治疗的患者发生免疫介导的甲状腺功能减退。42例患者中的5例事件消退。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者发生免疫介导的甲状腺功能减退,包括3级 (0.5%) 不良反应。
可能出现糖尿病酮症酸中毒的1型糖尿病:
IMJUDO 联合 Durvalumab
2例患者 (0.5%,2/388) 发生需要胰岛素治疗的高血糖事件,在末次随访时未消退。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,0.5%(3/596) 发生免疫介导的1型糖尿病,包括3级 (0.3%) 不良反应。所有患者均需要内分泌治疗。
5)免疫介导的肾炎伴肾功能不全
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的肾炎。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中0.7%(4/596) 发生免疫介导的肾炎,包括3级 (0.2%) 不良反应。
6)免疫介导的皮肤反应
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的皮疹或皮炎。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,7.2%(43/596) 发生免疫介导的皮疹或皮炎,包括3级 (0.3%) 不良反应。
7)免疫介导的胰腺炎
IMJUDO 联合 Durvalumab
IMJUDO 联合 durvalumab 可引起免疫介导的胰腺炎。
8)其他免疫介导的不良反应
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)联合治疗的患者或使用其他免疫检查点抑制剂的患者报告以下有临床意义、免疫介导的不良反应的发生率均低于1%。
心脏/血管:心肌炎、心包炎、血管炎。
神经系统:脑膜炎、脑炎、脊髓炎和脱髓鞘、肌无力综合征/重症肌无力(包括加重)、吉兰-巴雷综合征、神经轻瘫、自身免疫性神经病。
眼部:可能发生葡萄膜炎、虹膜炎和其他眼部炎症毒性。部分病例可合并视网膜脱离。可能发生各种级别的视力损害,包括失明。如果葡萄膜炎与其他免疫介导的不良反应同时发生,考虑为 Vogt-Koyanagi-Harada-样综合征,因为这可能需要全身性类固醇治疗,以降低永久性视力丧失的风险。
胃肠道:胃炎、十二指肠炎。
各种肌肉骨骼及结缔组织疾病:肌炎/多发性肌炎、横纹肌溶解及相关后遗症,包括肾衰竭、关节炎、风湿性多肌痛。
内分泌:甲状旁腺功能减退症。
其他(血液学/免疫):溶血性贫血、再生障碍性贫血、噬血细胞性淋巴组织细胞增生症、全身炎症反应综合征、组织细胞坏死性淋巴结炎(Kikuchi淋巴结炎)、结节病和免疫性血小板减少症。
2、输液相关反应
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起重度或危及生命的输注相关反应。
根据严重程度中断、减慢或永久停用曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)[参见用法用量]。对于1级或2级输注相关反应,考虑在后续给药时使用前驱用药。
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)联合治疗组10例 (2.6%) 患者发生输注相关反应。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中2.9%(17/596) 发生输注相关反应,包括3级 (0.3%) 不良反应。
3、胚胎毒性
基于动物研究的结果及其作用机制,当对孕妇给药时,IMJUDO可导致胎儿损害。
1、妊娠
已知人免疫球蛋白 G2(IgG2) 可穿过胎盘屏障;因此,曲美木单抗(IMJUDO)有可能从母体传递给发育中的胎儿。基于动物研究的结果及其作用机制,当对孕妇给药时,曲美木单抗(IMJUDO)可导致胎儿损害。
2、哺乳期
尚无关于人乳汁中存在tremelimumab-actl、其对母乳喂养婴儿或乳汁生成影响的数据。由于母乳喂养婴儿可能发生严重不良反应,建议女性在曲美木单抗(IMJUDO)治疗期间和末次给药后3个月内不要哺乳。
3、有生育能力的女性和男性
建议有生育能力的女性在曲美木单抗(IMJUDO)治疗期间和末次给药后3个月内采取有效的避孕措施。
4、儿童用药
尚未确定 tremelimumab-actl 在儿科患者中的安全性和有效性。
5、老年患者用药
在接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗的393例 uHCC 患者中,50%的患者为65岁或以上,13%的患者为75岁或以上。未观察到曲美木单抗(IMJUDO)在65岁或以上患者与年轻成人患者之间的安全性或疗效总体差异。
无
本品的主要成分为曲美木单抗
澄清至略带乳光、无色至浅黄色溶液
1、在原始纸箱中于2℃-8℃ (36℉-46℉) 冰箱中避光储存。
2、请勿冷冻。
3、请勿振摇。
AstraZeneca Pharmaceuticals
1、针对不可切除的肝细胞癌 (HCC)治疗效果
在 HIMALAYA 研究 (NCT03298451) 中评价了 IMJUDO 联合 durvalumab 的疗效,该研究是一项在既往未接受过 HCC 全身治疗的确诊 uHCC 患者中进行的随机 (1:1:1)、开放性、多中心研究。
疗效结果见表1和图1
表1:HIMALAYA研究的疗效结果
|
终点 |
IMJUDO 和 Durvalumab(N = 393) |
索拉非尼 (N = 389) |
|
OS |
||
|
死亡人数 (%) |
262 (66.7) |
293 (75.3) |
|
中位OS(月) |
16.4 |
13.8 |
|
(95% CI) |
(14.2, 19.6) |
(12.3, 16.1) |
|
HR(95%CI)1 |
0.78 (0.66, 0.92) |
|
|
p 值2,3 |
0.0035 |
|
|
无进展生存期 |
||
|
事件数量 (%) |
335 (85.2) |
327 (84.1) |
|
中位PFS(月) |
3.8 |
4.1 |
|
(95% CI) |
(3.7, 5.3) |
(3.7, 5.5) |
|
HR(95%CI)1 |
0.90 (0.77, 1.05) |
|
|
客观缓解率 |
||
|
ORR%(95%CI)4,5 |
20.1 (16.3, 24.4) |
5.1 (3.2, 7.8) |
|
完全缓解 n(%) |
12 (3.1) |
0 |
|
部分缓解 n(%) |
67 (17.0) |
20 (5.1) |
|
DoR |
||
|
中位DoR(月) (95% CI) |
22.3 (13.7, NR) |
18.4 (6.5, 26.0) |
|
持续时间≥6个月的患者百分比 |
82.3 |
78.9 |
|
持续时间≥12个月的患者百分比 |
65.8 |
63.2 |
1基于分层 Cox 比例风险模型的HR(IMJUDO和durvalumab vs.索拉非尼)。
2基于分层对数秩检验。
3基于具有O’Brien Fleming型边界的Lan-DeMetsα消耗函数和观察到的实际事件数量,宣布 IMJUDO 和 durvalumab 与索拉非尼相比具有统计学显著性的边界为0.0398 (Lan and DeMets 1983)。
4经证实的完全缓解或部分缓解。
5基于 Clopper-Pearson 方法。
CI = 置信区间,HR = 风险比,NR = 未达到
图1:OS的 Kaplan-Meier 曲线

2、针对转移性非小细胞肺癌(NSCLC)治疗效果
在POSEIDON(一项随机、多中心、活性对照、开放性试验,NCT03164616)中研究了 IMJUDO 联合 durvalumab 和含铂化疗在既往未经治疗的无致敏表皮生长因子受体 (EGFR) 突变或间变性淋巴瘤激酶 (ALK) 基因组肿瘤畸变的转移性 NSCLC 患者中的疗效。
主要疗效结局指标是 IMJUDO 和 durvalumab 联合铂类药物化疗与单独铂类药物化疗相比的无进展生存期 (PFS) 和总生存期 (OS)。其他疗效结局指标为总缓解率 (ORR) 和缓解持续时间 (DoR)。根据RECIST v1.1,采用盲态独立中心审查 (BICR) 评估PFS、ORR和DoR。
疗效结果总结见表2和图2。
表2:POSEIDON的疗效结果
|
|
IMJUDO 联合 durvalumab 和含铂化疗 (n = 338) |
含铂化疗 (n = 337) |
|
OS 1 |
|
|
|
死亡人数 (%) |
251 (74) |
285 (85) |
|
中位OS(月) |
14.0 |
11.7 |
|
(95% CI) |
(11.7, 16.1) |
(10.5, 13.1) |
|
HR(95%CI) |
0.77 (0.65, 0.92) |
|
|
p 值2 |
0.00304 |
|
|
PFS 1 |
|
|
|
事件数量 (%) |
238 (70) |
258 (77) |
|
中位PFS(月) |
6.2 |
4.8 |
|
(95% CI) |
(5.0, 6.5) |
(4.6, 5.8) |
|
HR(95%CI) |
0.72 (0.60, 0.86) |
|
|
p 值2 |
0.00031 |
|
|
ORR%(95%CI)3 |
39 (34, 44) |
24 (20, 29) |
|
中位DoR(月) |
9.5 |
5.1 |
|
(95% CI) |
(7.2, NR) |
(4.4, 6.0) |
1PFS/OS 结果基于分别在研究开始后25/45个月进行的计划分析。
2双侧 p 值基于按PD-L1、组织学和疾病分期分层的对数秩检验,与 PFS 的边界值0.00735和 OS 的边界值0.00797相比。
3确认缓解及 95%Clopper-Pearson 置信区间。NR = 未达到,CI = 置信区间
图2:POSEIDON中 OS 的 Kaplan-Meier 曲线

1、推荐剂量
曲美木单抗(Tremelimumab,IMJUDO)联合durvalumab(德瓦鲁单抗)治疗不可切除的肝细胞癌 (uHCC) 成人患者见表1
表1:曲美木单抗的推荐剂量
|
适应症 |
曲美木单抗推荐剂量 |
治疗持续时间 |
|
肝细胞癌 (uHCC) |
一、体重≥30 kg的患者: 1、第1周期第1天单次给药曲美木单抗300mg*,随后给予德瓦鲁单抗(durvalumab) 1,500 mg**; 2、继续给予德瓦鲁单抗(durvalumab) 1,500 mg单药治疗,每4周一次 二、体重低于 30 kg 的患者: 1、第1周期第1天单次给药曲美木单抗4 mg/kg*,随后德瓦鲁单抗(durvalumab) 20 mg/kg**; 2、继续给予德瓦鲁单抗(durvalumab)20 mg/kg 单药治疗,每4周一次 |
联合治疗第1周期后,德瓦鲁单抗(durvalumab) 单药给药,每4周一次,直至疾病进展或出现不可接受的毒性 |
*在同一天durvalumab(德瓦鲁单抗)给药前给予曲美木单抗(IMJUDO)
**曲美木单抗(Tremelimumab,IMJUDO)联合durvalumab(德瓦鲁单抗)和含铂化疗
曲美木单抗(Tremelimumab,IMJUDO)治疗转移性非小细胞肺癌 (NSCLC) 的推荐给药方案见表2和表3。
每次输注前称量患者体重。
根据患者体重和肿瘤组织学,使用下表3计算适当剂量。
表2:推荐剂量方案
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
循环: |
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
|
6 |
|
|
|
7 |
|
|
|
8 |
|
IMJUDO 3,4 |
X |
|
|
X |
|
|
X |
|
|
X |
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
Durvalumab 1,3 |
X |
|
|
X |
|
|
X |
|
|
X |
|
|
X |
|
|
|
X |
|
|
|
X |
|
|
|
X |
|
化疗 |
X |
|
|
X |
|
|
X |
|
|
X |
|
|
X5 |
|
|
|
X5 |
|
|
|
X5 |
|
|
|
X5 |
|
周期1,2 |
|||||||||||||||||||||||||
1持续接受 durvalumab 治疗,直至疾病进展或出现不可耐受的毒性。
2从第5周期开始,给药间隔从每3周一次变为每4周一次。
3静脉输注 60 min。
4如果患者接受少于4个周期的铂类药物化疗,则其余周期IMJUDO(最多共5个周期)应在铂类药物化疗期后给药,联合durvalumab,每4周一次。
5对于接受培美曲塞和卡铂/顺铂治疗的非鳞状疾病患者,从第12周开始可选择培美曲塞治疗,直至疾病进展或出现不可耐受的毒性。
表3:推荐方案和剂量
|
肿瘤组织学 |
患者体重 |
IMJUDO 剂量 |
Durvalumab 1 剂量 |
含铂化疗方案1 |
|
非鳞状 |
≥30 kg |
75 mg |
1,500 mg |
1、卡铂和白蛋白结合型紫杉醇 2、卡铂或顺铂和培美曲塞 |
|
< 30 kg |
1 mg/kg |
20 mg/kg |
||
|
鳞状 |
≥30 kg |
75 mg |
1,500 mg |
1、卡铂和白蛋白结合型紫杉醇 2、卡铂或顺铂和吉西他滨 |
|
< 30 kg |
1 mg/kg |
20 mg/kg |
3、针对不良反应的剂量调整
不建议因治疗而减少剂量。一般情况下,如果发生重度(3级)免疫介导的不良反应,暂停治疗方案。如果在开始皮质类固醇治疗后12周内发生危及生命(4级)的免疫介导的不良反应、复发性重度(3级)免疫介导的反应,需要全身免疫抑制治疗,或无法将皮质类固醇剂量减至≤10 mg/天泼尼松或等效药物,则永久终止治疗方案。推荐的治疗调整见表4。
表4:不良反应的推荐剂量调整
ALT = 丙氨酸氨基转移酶,AST = 天冬氨酸氨基转移酶,DRESS = 伴有嗜酸性粒细胞增多和全身症状的药疹,SJS = Stevens Johnson综合征,TEN = 中毒性表皮坏死松解症,ULN = 正常上限
1基于美国国家癌症研究所不良事件通用术语标准4.03版。
2皮质类固醇减量后完全或部分缓解(0-1级)的患者重新开始治疗。如果在开始类固醇治疗后12周内未完全或部分消退,或在开始皮质类固醇治疗后12周内无法将皮质类固醇剂量减至 10 mg 泼尼松或更低剂量/天(或等效药物),则永久停药。
3如果基线时肝脏受累患者的 AST 和ALT≤ULN,则根据无肝脏受累的肝炎建议,暂停或永久停用durvalumab。
制备和给药
准备:
1、目视检查制剂是否存在颗粒物和变色。如果溶液浑浊、变色或观察到可见异物,则丢弃。
2、请勿振摇小瓶。
3、从曲美木单抗(IMJUDO)药瓶中抽取所需体积,并丢弃装有任何未使用部分的药瓶。
4、转移至含有0.9%氯化钠注射液 (USP) 或5%葡萄糖注射液 (USP) 的静脉输液袋中,并稀释至浓度为0.1 mg/mL-10 mg/mL。轻轻翻转,混匀稀释溶液。请勿振摇溶液。
稀释曲美木单抗(IMJUDO)输注溶液的储存
1、曲美木单抗(IMJUDO)不含防腐剂。制备后立即给予输注溶液。如果输注溶液不立即给药且需要储存,则从制备至开始给药的总时间不应超过:
1)2°C-8°C(36°F-46°F) 冰箱中24小时
2)室温高达30℃ (86℉) 下24小时
2、请勿冷冻。
3、请勿振摇。
给药:
1、曲美木单抗(IMJUDO)输注溶液通过含0.2或0.22微米无菌低蛋白结合过滤器的静脉管路在 60 min 内静脉给药。
2、每种制剂使用单独的输液袋和过滤器。
曲美木单抗(IMJUDO)联合其他药物
1、所有药品均单独静脉输注给药。
2、请勿通过同一输液管与其他药物联合给药。
3、关于铂类药物化疗的给药信息,请参阅处方信息。
4、对于培美曲塞治疗,给药信息请参见处方信息。
联合治疗方案:输注顺序
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)
给药顺序:在给药当天输注IMJUDO,随后输注durvalumab。
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗
给药顺序:给药当天首先输注IMJUDO,随后输注durvalumab,然后输注含铂化疗。
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和培美曲塞治疗
给药顺序:给药当天首先输注IMJUDO,随后输注durvalumab,然后输注培美曲塞。
联合治疗方案:输注说明
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)
输注说明:IMJUDO输注完成后观察患者 60 min[参见警告和注意事项]。然后在 60 min 内单独静脉输注 durvalumab。
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗/培美曲塞治疗第1周期:
输注说明:IMJUDO输注1小时。IMJUDO输注完成后1-2小时,在1小时内输注durvalumab。durvalumab输注完成后1-2小时,给予铂类药物化疗。
后续周期:如果在周期1期间没有输注反应,后续周期的 durvalumab 可以在 IMJUDO 给药后立即给药。durvalumab输注结束和化疗开始之间的时间可以缩短至30 min。
一、只接受曲美木单抗(IMJUDO)治疗的常见不良反应:
1、恶心 (37%)、食欲减退 (25%) 和疲乏 (22%)。
2、最常见的3级或4级 (> 10%) 实验室检查异常为:
1)中性粒细胞减少症 (39%)、白细胞减少症 (21%)、淋巴细胞减少症(20%)
2)贫血 (20%)、低钠血症 (14%)、脂肪酶升高 (12%) 和血小板减少症 (11%)
二、曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗肝细胞癌常见不良反应:
1、胃肠道疾病:腹泻、腹痛、恶心
2、皮肤及皮下组织类疾病:皮疹、瘙痒
3、代谢及营养类疾病:食欲减退
4、全身性疾病及给药部位各种反应:疲乏、发热
5、精神疾病:失眠
6、内分泌系统疾病:甲状腺功能减退症
7、各种肌肉骨骼及结缔组织疾病:肌肉骨骼疼痛
三、曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗治疗非小细胞肺癌常见不良反应:
1、呼吸系统、胸及纵隔疾病:咳嗽、咳痰
2、胃肠道疾病:恶心、腹泻、便秘、呕吐、口腔炎
3、内分泌系统疾病:甲状腺功能减退症
4、皮肤及皮下组织类疾病:皮疹、脱发、瘙痒
5、全身性疾病及给药部位各种反应:疲乏、乏力、发热、水肿
6、各种肌肉骨骼及结缔组织疾病:肌肉骨骼疼痛
7、代谢及营养类疾病:食欲减退
8、感染及侵染类疾病:感染性肺炎、上呼吸道感染
9、神经系统疾病:头痛
最常见3级或4级实验室检查异常为:
1、中性粒细胞减少症、贫血、白细胞减少症、淋巴细胞减少症
2、脂肪酶升高、低钠血症和血小板减少症。
1、免疫介导的重度和致死性不良反应
曲美木单抗(IMJUDO)是一种单克隆抗体,可阻断 CTLA-4 通路诱导的 T 细胞抑制信号,从而消除对免疫应答的抑制。与 PD-L1 抑制剂德瓦鲁单抗(Durvalumab)联合使用,这些药物有可能诱导免疫介导的不良反应。此处列出的免疫介导不良反应可能不包括所有可能的重度和致死性免疫介导反应。
任何器官系统或组织均可能发生免疫介导的不良反应,可能为重度或致死性。免疫介导的不良反应可发生在曲美木单抗(IMJUDO)与 德瓦鲁单抗(Durvalumab)联合治疗开始后的任何时间。虽然免疫介导的不良反应通常在治疗期间出现,但曲美木单抗(IMJUDO)和/或德瓦鲁单抗(Durvalumab)停药后也可能出现免疫介导的不良反应。
1)免疫介导性肺炎
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的肺炎,可能是致命的。
IMJUDO 联合 Durvalumab和含铂化疗
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中3.5%(21/596) 发生免疫介导的肺炎,包括致死性 (0.5%) 和3级 (1%) 不良反应。
2)免疫介导的结肠炎
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗的患者中有6%(23/388) 发生免疫介导的结肠炎或腹泻,包括3级 (3.6%) 不良反应。
IMJUDO 联合 Durvalumab和含铂化疗
IMJUDO 联合 durvalumab 和含铂化疗可引起免疫介导的结肠炎,可能具有致死性。
3)免疫介导的肝炎
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的肝炎,可能是致命的。
IMJUDO 联合 Durvalumab和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的3.9%(23/596) 患者发生免疫介导的肝炎,包括致死性 (0.3%)、4级 (0.5%) 和3级 (2%) 不良反应。
4)免疫介导的内分泌病
肾上腺功能不全:
IMJUDO 联合 Durvalumab
1.5%(6/388) 接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗的患者发生免疫介导的肾上腺功能不全,包括3级 (0.3%) 不良反应。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,2.2%(13/596) 发生免疫介导的肾上腺功能不全,包括3级 (0.8%) 不良反应。
垂体炎:
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的垂体炎。
IMJUDO 联合 Durvalumab 和含铂化疗
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中1.3%(8/596) 发生免疫介导的垂体炎,包括3级 (0.5%) 不良反应。
甲状腺疾病:
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的甲状腺疾病。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,1.2%(7/596) 发生免疫介导的甲状腺炎。
甲状腺功能亢进症:
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)治疗的患者发生免疫介导的甲状腺功能亢进,包括3级 (0.3%) 不良反应。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中5%(30/596) 发生免疫介导的甲状腺功能亢进,包括3级 (0.2%) 不良反应。
甲状腺功能减退:
IMJUDO 联合 Durvalumab
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)联合治疗的患者发生免疫介导的甲状腺功能减退。42例患者中的5例事件消退。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者发生免疫介导的甲状腺功能减退,包括3级 (0.5%) 不良反应。
可能出现糖尿病酮症酸中毒的1型糖尿病:
IMJUDO 联合 Durvalumab
2例患者 (0.5%,2/388) 发生需要胰岛素治疗的高血糖事件,在末次随访时未消退。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,0.5%(3/596) 发生免疫介导的1型糖尿病,包括3级 (0.3%) 不良反应。所有患者均需要内分泌治疗。
5)免疫介导的肾炎伴肾功能不全
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的肾炎。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中0.7%(4/596) 发生免疫介导的肾炎,包括3级 (0.2%) 不良反应。
6)免疫介导的皮肤反应
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起免疫介导的皮疹或皮炎。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和铂类药物化疗的患者中,7.2%(43/596) 发生免疫介导的皮疹或皮炎,包括3级 (0.3%) 不良反应。
7)免疫介导的胰腺炎
IMJUDO 联合 Durvalumab
IMJUDO 联合 durvalumab 可引起免疫介导的胰腺炎。
8)其他免疫介导的不良反应
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)联合治疗的患者或使用其他免疫检查点抑制剂的患者报告以下有临床意义、免疫介导的不良反应的发生率均低于1%。
心脏/血管:心肌炎、心包炎、血管炎。
神经系统:脑膜炎、脑炎、脊髓炎和脱髓鞘、肌无力综合征/重症肌无力(包括加重)、吉兰-巴雷综合征、神经轻瘫、自身免疫性神经病。
眼部:可能发生葡萄膜炎、虹膜炎和其他眼部炎症毒性。部分病例可合并视网膜脱离。可能发生各种级别的视力损害,包括失明。如果葡萄膜炎与其他免疫介导的不良反应同时发生,考虑为 Vogt-Koyanagi-Harada-样综合征,因为这可能需要全身性类固醇治疗,以降低永久性视力丧失的风险。
胃肠道:胃炎、十二指肠炎。
各种肌肉骨骼及结缔组织疾病:肌炎/多发性肌炎、横纹肌溶解及相关后遗症,包括肾衰竭、关节炎、风湿性多肌痛。
内分泌:甲状旁腺功能减退症。
其他(血液学/免疫):溶血性贫血、再生障碍性贫血、噬血细胞性淋巴组织细胞增生症、全身炎症反应综合征、组织细胞坏死性淋巴结炎(Kikuchi淋巴结炎)、结节病和免疫性血小板减少症。
2、输液相关反应
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)可引起重度或危及生命的输注相关反应。
根据严重程度中断、减慢或永久停用曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)[参见用法用量]。对于1级或2级输注相关反应,考虑在后续给药时使用前驱用药。
IMJUDO 联合 Durvalumab
曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)联合治疗组10例 (2.6%) 患者发生输注相关反应。
IMJUDO 联合 Durvalumab 和含铂化疗
接受曲美木单抗(IMJUDO)联合德瓦鲁单抗(Durvalumab)和含铂化疗的患者中2.9%(17/596) 发生输注相关反应,包括3级 (0.3%) 不良反应。
3、胚胎毒性
基于动物研究的结果及其作用机制,当对孕妇给药时,IMJUDO可导致胎儿损害。


曲美木单抗
癌症疫苗
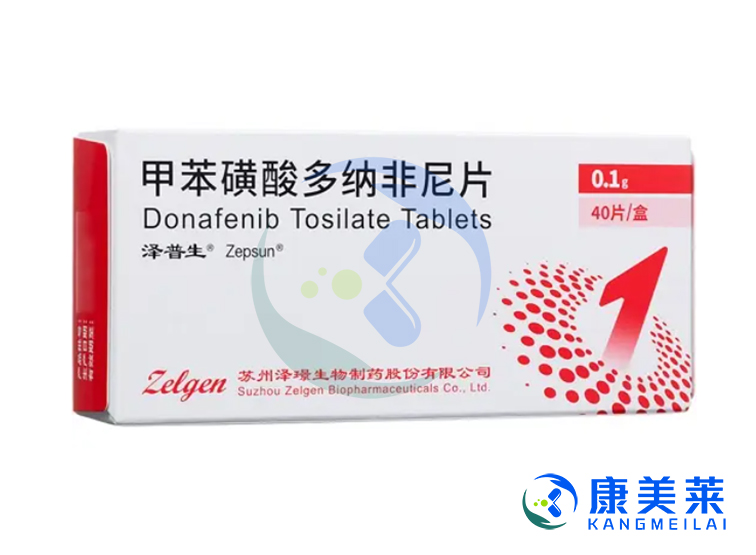
多纳非尼
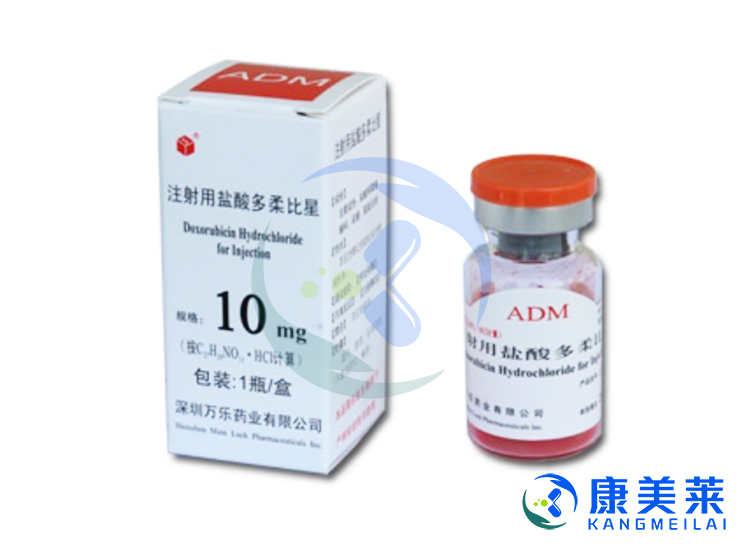
阿霉素(adriamycin)
表阿霉素(Epirubicin)